BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s) + 3C(s) + 3Cl2(g)  2BCl3 (g) + 3CO(g)。
2BCl3 (g) + 3CO(g)。
(1)反应起始至3min时固体质量减少了15.9克,则氯气的平均反应速率为_____________。
(2)反应至4min时达到平衡,则下列说法正确的是____________(填序号)。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①A、D之间导线中电子移动方向为_______________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
某双原子分子构成的气体,其摩尔质量为M (g·mol-1),已知阿伏加德罗常数为NA (mol-1),标准状况下气体摩尔体积为Vm (L·mol-1),现有质量为n g的该气体,则:
(1) 该气体的物质的量为mol。
(2) 该气体在标准状况下的体积为L。
(3) 该气体所含原子总数为个。
(9分)根据右图物质之间的转化关系,回答: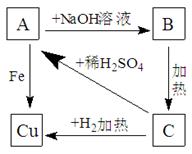
(1)写出A、B、C的化学式:
A___________;B___________;C___________。
(2)写出下列各步的化学反应方程式:
A→B:_____________________________________;
A→Cu:____________________________________。
B→C:_____________________________________。
(12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:
属于酸性氧化物的有_____________,属于碱性氧化物的有_____________,
属于盐的有__________________________________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________,
④ 不属于四种基本反应类型的氧化还原反应_______________________________。
将10.6克Na2CO3溶于水制成2L溶液,该溶液中的物质的量浓度为____________mol/L,溶液中Na+ 的物质的量浓度是__________mol/L
标准状况下,11.2LCO2的物质的量是________ mol, 质量是g, 含个氧原子。