被称为“软电池“的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内为离子“流过”水和氯化锌组成的电解液。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列有关说法中正确的是( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化作用 |
| C.当0.1molZn完全反应时,流经电解液的电子个数为1.204×1023 |
| D.电池的正极反应式为2MnO2+2H2O+2eˉ=2MnO(OH)+2OHˉ |
己知0.1mol/LNaHCO3溶液显碱性,将此溶液加水稀释后,下列说法正确的是()
| A.稀释后,溶液中各离子浓度均变小。 |
| B.原溶液中,C(Na+)= C(HCO3-) + C(H2CO3) = 0.1mol/L |
| C.稀释后,溶液中C(Na+)/ C(HCO3-)比值增大 |
| D.原溶液加入少量NaOH溶液后,其碱性减弱。 |
现有3个体积相等的密闭容器,都进行下列反应:CO2(g) + H2(g) H2O(g) + CO(g),
H2O(g) + CO(g),
反应所处的温度相同,但起始浓度不同,其中甲:n(CO2) = n(H2) = 1 mol;
乙:n(CO2)=1 mol,n(H2)=2mol;丙:n(CO2)=n(H2)=1mol,n[H2,O(g)]=1 mol。
达到平衡时CO的物质的量由大到小的顺序是()
| A.乙>甲>丙 | B.甲>丙>乙 | C.乙>丙>甲 | D.甲>乙>丙 |
下列叙述正确的是( )
| A.氯化钠溶液在电流作用下电离成Na+与Cl‑ |
| B.溶于水后能电离出H+的化合物都是酸 |
| C.氯化氢溶于水后能导电,但液态氯化氢不能导电 |
| D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
已知氯化银在水中存在沉淀溶解平衡:AgCl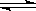 Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是()
Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是()
| A.100mL蒸馏水中 | B.50mL0.1mol•L-1的氯化镁溶液 |
| C.150mL0.1mol•L-1的氯化钠溶液 | D.50mL0.1mol•L-1的氯化铝溶液 |
下列叙述正确的是( )
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |