I、右图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:

(1)用系统命名法命名 。
(2)M的一氯代物有 种。
(3)含有一个甲基和一个乙基的M的同分异构体有 种。
Ⅱ、利用右图装置还可以验证醋酸、苯酚、碳酸的酸性强弱。

(4)A中固体试剂是 (选填字母);
a.醋酸钠 b.碳酸氢钠 c.苯酚钠
(5)C中反应的化学方程式是: ;
(6)有同学认为没有B装置,也可以验证酸性的强弱,
这种认为是不合理的,原因是 。
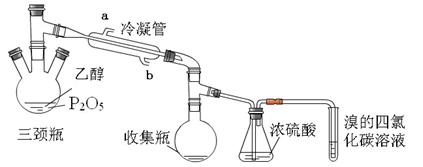
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
| 实验 |
P2O5 /g |
95%乙醇量/ mL |
加热方式 |
| 实验1 |
2 |
4 |
酒精灯 |
| 实验2 |
2 |
4 |
水浴70℃ |
实验结果如下:
| 实验 |
实验现象 |
||
| 三颈瓶 |
收集瓶 |
试管 |
|
| 实验1 |
酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 |
有无色液体 |
溶液褪色 |
| 实验2 |
酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 |
有无色液体 |
溶液不褪色 |
根据上述资料,完成下列填空。
(1)写出乙醇制乙烯的化学方程式。
(2)上图装置中泠凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作
用是。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有、(加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间
| 实验编号 |
①中的物质 |
②中的物质 |
| 1 |
淀粉碘化钾溶液 |
浓硝酸 |
| 2 |
酚酞溶液 |
浓硫酸 |
| 3 |
氯化铝溶液 |
浓氨水 |
| 4 |
湿润的红纸 |
饱和氯水 |
实验1、2、3、4烧杯①中的现象分别是,,,,
(2)用下图装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)
(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题.
①若要测定生成的NH3的体积,则必须选择的装置是(填装置序号),装置中所盛试剂应具有的性质是.收集干燥的NH3,收集装置应选择(填装置序号),理由是.
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1—10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式。
(4)下图是苯与溴发生反应并进行产物检验的反应装置
实验装置中的冷凝管“左低右高”的放置目的是____________,整套实验装置中能防止倒吸的装置是______________(填装置序号)
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫。
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)_____________。
(6)如果要验证③是否成立的实验方法是______________________
为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)
实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,单后关闭K1、K2、K3 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅵ,检验B溶液中的离子.
(1)过程Ⅰ的目的是___________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_____________________________________________
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是___________________
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是
| 过程ⅣB溶液中含有的离子 |
过程ⅥB溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(7)进行实验过程Ⅴ时,B中的溶液颜色由黄色变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq)  FeSO3(s)
FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色。
某同学设计如下实验,正式该假设的成立:
溶液E和F分别是___________、_______________
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因___________________________
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
| II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是。
(2)实验操作II吹入热空气的目的是。
(3)装置C的作用是,C中盛放的药品是。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式。
(5)由上述实验得出的结论是。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
。