下列装置能达到实验目的的是
下列实验操作与预期实验目的或实验结论一致的是
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
测同浓度的Na2CO3、CH3COONa 溶液的PH值前者大 |
酸性强弱:CH3COOH 比H2CO3强 |
| B |
向某溶液加入盐酸酸化的氯化钡溶液有沉淀产生 |
说明此溶液中一定含SO42‾ |
| C |
向Na2SiO3溶液中通入CO2出现浑浊 |
非金属性强弱:C>Si |
| D |
比较H2O和H2S的沸点前者大 |
非金属性:O>S |
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ;
③用HNO2溶液做导电实验时,灯泡很暗;④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2;⑥HNO2不稳定,易分解
| A.①②③⑤ | B.①②④⑤ | C.①②⑥ | D.①② |
某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K= |
| B.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 |
| C.增大该体系的压强,A的转化率增大 |
| D.该条件下B的平衡转化率是40% |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是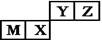
| A.原子半径Z<M |
| B.Z位于元素周期表中第二周期,第ⅥA族 |
| C.X的最简单气态氢化物的热稳定性比Z的小 |
| D.Y的最高价氧化物对应水化物的酸性比X的弱 |