我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2 CO2+H2O。下列有关说法正确的是
CO2+H2O。下列有关说法正确的是
| A.该反应为吸热反应 | B.CO2分子由极性键形成的极性分子 |
| C.HCHO分子中有3个σ键,1个π键 | D.每生成1.8gH2O消耗2.24L O2 |
各组性质比较的表示中,正确的是
| A.沸点:Cl2<F2<Br2<I2 | B.沸点:HF<HCl<HBr<HI |
| C.氧化性:F2<Cl2<Br2<I2 | D.还原性:HF<HCl<HBr<HI |
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应2H2SO3 +O2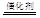 2H2SO4 2H2SO4 |
B.工业上制取粗硅的化学方程式:SiO2+C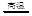 Si+CO2↑ Si+CO2↑ |
| C.Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O |
下列有关说法错误的是
| A.H2O2、Na2O2都属于过氧化物、都存在非极性共价键 |
| B.H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 |
| C.双氧水是绿色氧化剂,可作医疗消毒剂 |
| D.H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
下列物质中,不能由单质直接化合生成的是
①CuS②FeS③SO3④H2S⑤FeCl2
| A.①③⑤ | B.①②③⑤ | C.①②④⑤ | D.全部 |
家用消毒柜常用臭氧(O3)消毒,在消毒过程中通过放电发生如下反应:3O2(g)=2O3(g)
△H=+144.8kJ/mol;下列关于臭氧说法不正确的是
| A.O2和O3互为同素异形体 |
| B.O3具有较强的氧化性 |
| C.O2比O3稳定 |
| D.植物油等食物为防止细菌污染,可放入消毒柜中消毒 |