某同学按下述操作配制100 mL 0.20 mol·L-1Na2SO4溶液,请回答有关问题。
| (1)实验步骤 |
有关问题 |
| ①计算所需Na2SO4的质量 |
需要称量Na2SO4的质量为________g |
| ②称量Na2SO4固体 |
称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100 mL烧杯中,并加入适量水 |
用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) |
仪器A是________________; |
| ⑤洗涤烧杯,转移,定容 |
|
| ⑥摇匀、装瓶、贴上标签 |
(2)取出该Na2SO4溶液10 mL加水稀释到100 mL,稀释后溶液中Na+的物质的量浓度是__________。
(3)在实验中,以下操作对实验结果没有影响的是__________。
A.没有将洗涤液转移到容量瓶中
B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:__________________________。
海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
回答下列问题:
(4)在A中加入30 .0mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①在该实验中, B装置的名称是__________,A的容积最适合的是_________(填编号)
a.25mL b.50mL c.100mL d.250mL
②收集溴苯时,应根据_________(填“C1”或“C2”)所显示的温度,其温度应为_________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有_______________________(填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案__________(填“合理”或“不合理”),理由是__________________。
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。
| 物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
| 密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
| 熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
| 沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
| 在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。
实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ
验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器。
请回答下列问题:
(1)①仪器A的名称是,仪器B中应加入的固体药品 (填化学式);
②实验中观察到D内红棕色气体的化学式为,证明氨气具有性;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为;
②此时仪器C中改为盛装P2O5 的作用是。
某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题: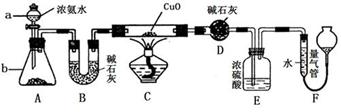
(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
溴乙烷是一种重要的化工合成原料。实验室合成溴乙烷的反应和实验装置如下:
反应:CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O
装置:
实验中可能用到的数据如下表:
| 物质 |
相对分子质量 |
沸点/℃ |
密度/g/cm3 |
水溶性 |
| CH3CH2OH |
46 |
78.4 |
0.79 |
互溶 |
| CH3CH2Br |
109 |
38.4 |
1.42 |
难溶 |
| CH3CH2OCH2CH3 |
74 |
34.5 |
0.71 |
微溶 |
| CH2=CH2 |
28 |
-103.7 |
0.38 |
不溶 |
| 浓硫酸(H2SO4) |
98 |
338.0 |
1.38 |
易溶 |
①合成反应:在仪器B中加入适量NaBr、浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物。
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷。
回答下列问题:
(1)仪器B的名称是___________。
(2)仪器C为直形冷凝管,冷水进口是___________(填“a”或“b”)。
(3)仪器D置于盛有_________的烧杯中,目的是__________________________________。
(4)装置A的名称为牛角管,其结构中的c支管的作用是___________________________。
(5)溴乙烷粗产品分离提纯阶段,加水的目的是___________________________________。
(6)该实验所得溴乙烷的产率为 ________________________。