下列有关氧化还原反应的叙述中,正确的是
| A.一定有氧元素参加 | B.氧化剂本身发生氧化反应 |
| C.氧化反应一定先于还原反应发生 | D.一定有电子转移(得失或偏移) |
在100mL 0.01mol/L KCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10)
| A.有AgCl沉淀析出 | B.无AgCl沉淀 |
| C.无法确定 | D.有沉淀但不是AgCl |
为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
| A.②④ | B.①②⑤ | C.③④⑤ | D.②③ |
下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.钢铁在潮湿的空气中容易生锈 |
| C.工业上生产硫酸的过程中,二氧化硫在接触室氧化时通入过量空气(O2) |
| D.工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=" -92.6" kJ / mol。测得数据如下表:
2NH3(g) △H=" -92.6" kJ / mol。测得数据如下表: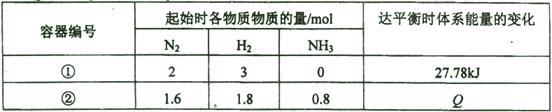
下列叙述不正确的是
| A.容器②中反应开始时v(正)> v(逆) |
| B.容器①、②中反应达平衡时压强相等 |
| C.容器②中反应达平衡时,吸收的热量Q为9.26 kJ |
| D.若条件为“绝热恒容”,容器①中反应达平衡时n (NH3)< 0.6 mol |
某学生用质量为a g、边长为b cm的正方形均匀镀锌铁片与适置盐酸反应测定镀层厚度,并将实验过程绘图示意,反应至t2时刻时,铁片质量为c g(已知锌的密为 g/cm3)。下列叙述错误的是
g/cm3)。下列叙述错误的是
| A.t1时刻锌镀层已完全反应 |
| B.反应放热也是影响OA段的反应速率的因素之一 |
C.锌镀层的厚度为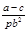 |
| D.过程中有原电池反应发生,负极的电极反应式为Zn - 2e= Zn2+ |