常温下,A是双原子分子气态单质,其密度为3.17g/L(标准标况下),B、C、D都是含A元素的化合物,转化关系如右图所示:

(1)分别写出下列物质的化学式:
B D
(2)试写出有关化学方程式:
A→B
D→A
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: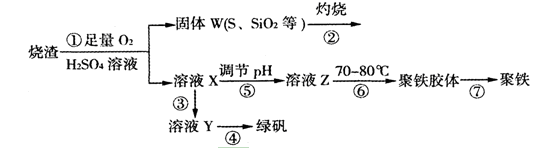
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是;
A.品红溶液B.紫色石蕊溶液 C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:;
(3)过程③中,需加入的物质是;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有;
(5)过程⑤调节pH可选用下列试剂中的(填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为。(假设杂质中不含铁元素和硫元素)。
有机物A是由C、H、O三种元素组成的五元环状化合物,其相对分子质量为98,其核磁共振氢谱只有1个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。G是一种合成橡胶和树脂的重要原料。已知: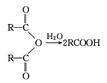
①② RCOOH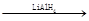 RCH2OH(其中R是烃基)
RCH2OH(其中R是烃基)
有关物质的转化关系如下图所示,请回答以下问题:
(1)A中不含氧的官能团名称是;⑤的反应类型是;G的结构简式为;G与Br2的CCl4溶液反应,产物有种(不考虑立体异构);
(2)反应②的化学方程式为;
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物;E也可自身两分子发生反应生成一种六元环状化合物,写出这种环状化合物的结构简式;
(4)反应⑥的化学方程式为;
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简 式。
【有机物化学基础】
某有机物X的相对分子质量小于100,取1 mol有机物X在O2中完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2 112 L。
(1)该有机物X的分子式为________(填序号)。
A C4H8B C2H4O C C4H8O2 D C10H20O20
(2)甲物质是X的同分异构体,分子中含有羰基和羟基,甲物质能发生如图所示的转化: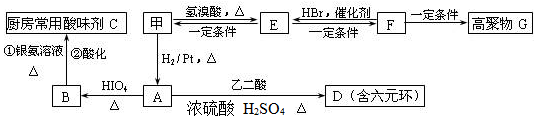
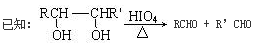
①B的名称是________。与A官能团相同的同分异构体共有______种(包括A但不含立体异构,已知同一个碳上有两个羟基的有机物不稳定)
②A→D的反应类型为________,E→F的反应条件是________。
③写出F→G的化学方程式__________________________________。
(3)物质乙也是X的同分异构体,1 mol乙与足量的Na反应可生成1 mol H2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积之比为2∶1∶1。物质乙的结构简式为_____。
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
| 阳离子 |
Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 |
SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______(填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______。
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______(填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为__________________。
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
【化学与技术】
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。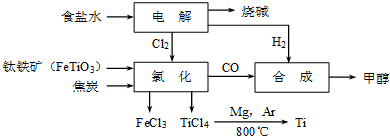
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图____。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式。
(3)氯碱厂获得Cl2的离子方程式为。
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为时,理论上Cl2的利用率最大。