填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
、向FeI2、FeBr2的混合 溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。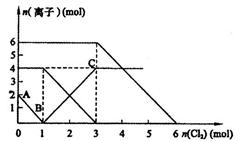
已知:2Fe2++Br2 2Fe3++2Br-2Fe3++2I-
2Fe3++2Br-2Fe3++2I- 2Fe2++I2
2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为  。
。
(2)当通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
(3)原混合溶液中FeBr2的物质的量为 。
(4)原溶液中:c (Fe2+)∶c (I-)∶c (Br-)= 。
软锰矿的主要成分是,实验室常用该主要成分与浓盐酸反应制氯气,其反应的离子方程式是,该反应中浓盐酸的作用是,常用的吸收处理多余氯气的方法中涉及的反应的离子方程式是。
实验室配制500mL 0.2mol/L Na2SO4溶液,所需仪器有;若实验操作中某同学在加蒸馏水至刻度线时仰视观察确定蒸馏水的加入量,则所配溶液浓度(选填“ 偏高”“偏低”或“无影响”)。
偏高”“偏低”或“无影响”)。
下图中,已知B溶液能使酚酞试液变红,且焰色反应呈黄色;下图中气体E在气体G中燃烧产生苍白色火焰,D、F相遇会产生白烟。请按要求填空: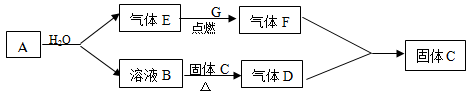
(1) A的名称是 ;F的化学式是。
;F的化学式是。
(2) B→D反应的化学方程式。
某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,将此混合气体经过浓硫酸后体积明显减少,将剩余气体排入空气中,很快变成红棕色。则原混合气体中:肯定含有,肯定不含有。