从铝土矿(主要成分是Al2O3,含Fe2O3、MgO和一些不溶于酸碱的杂质)中提取氧化铝两种工艺流程如下:

请回答下列问题:
(1)写出步骤②中加入烧碱后的离子方程式为_________________ _____________。
(2)列举氧化铝的两种常见的用途____ ______、________ __________。
(3)沉淀C的主要成分是______________ ______________(填化学式)。滤液D与少量CO2反应的离子方程式为___________ ________________。
(4)步骤③、④中不能用硫酸代替CO2,原因是__________________ _____________。向该滤液M中加入少量澄清石灰水的离子方程式为____________ ______________。
(5)沉淀F在过滤后需要洗涤,请写出检验F是否洗涤干净的方法_________ ________。
(6)若现在有10t的铝土矿,其中铝元素的质量分数为10.8%,则在流程乙中溶解时,需要4mol/L的NaOH溶液至少_____ __L。
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成。A、B、C相互转化关系如图所示(部分产物已略去)。
①A能使湿润的红色石蕊试纸变蓝;C、D为空气中的主要成分;B、E是有毒气体,它们的分子均由同周期元素原子构成。
②B和D相遇生成红棕色气体。
③F是形成酸雨的一种有害气体,有刺激性气味。
回答下列问题:
(1)C的电子式是。
(2)写出A→B的化学方程式。
(3)B和E发生反应的化学方程式是。
(4)常温下,把一定量的A通入水中,测得溶液的pH=12,则该溶液中由水电离出的OH—浓度为;该溶液中, 一定能大量共存的离子组是(填序号)。
一定能大量共存的离子组是(填序号)。
a.Na+NO—3 Fe2+C1— b.Ag+Mg2+Ca2+NO—3
c.Al3+K+A1O—3 C1— d.CO2-3Na+K+NO—3
(5)简述实验室验证F存在的方法。
已知A(g)+B(g) C(g)+D(g);△H="a" kJ/mol。反应过程中能量变化如图所示,E为反应发生所需要的能量。回答下列问题。
C(g)+D(g);△H="a" kJ/mol。反应过程中能量变化如图所示,E为反应发生所需要的能量。回答下列问题。
(1)该反应的△H0(选填“>”“<”)。当反应达到平衡时,升高温度,A的转化率(选填“增大”“减小”“不变”)。
(2)在某温度下,反应物的起始浓度分别为:c(A)=1mol/L,c(B)=2.4mol/L。达到平衡后,A的物质的量浓度为0.4mol/L,此时B的转化率为。
(3)一定条件下,向体积为2 L的恒容密闭容器中充入l mol A(g)和3 mol B(g),判断该反应达到平衡状态的依据是(填序号)。
①c(A)=c(C)
②容器内压强不变
③混合气体的平均相对分子质量不变
④v(逆)(D)=v(正)B
(4)在反应体系中加入催化剂后反应速率增大,反应发生所需要的能量E1E(选填“>”“<”“=”),这是因为;△H(选填“增大”“减小”“不变”),这是因为。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a.NH3 b.CO2 c.NaOH d.HNO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是
以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是
。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不有石墨作阳极的原因是。
(3)利用右图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于处。若X为锌,开关K置于M处,该电化学防护法称为。
某化学反应2A  B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。 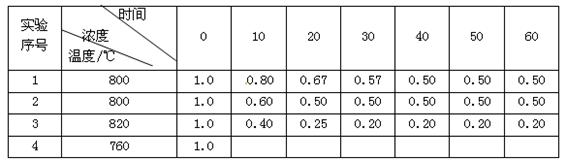
根据上述数据,回答下列问题:
(1)在实验1中,0~10min内的反应速率v(A)为 mol•L -1••min -1。
(2)与实验1相比,实验2的反应速率更 (填"快"或"慢"),其原因可能是 。
(3)根据实验1和实验3的数据分析升温对该反应的影响,写出两条结论:① ;
② 。
(4)实验4只改变温度,其它条件不变。请在答题卡的相应位置画出实验1和实验4的"浓度-时间"关系曲线。 
阻垢剂可防止工业用水过程中无机物沉积结构,经由下列反应路线可得知到E和R两种阻垢剂(部分反应条件略去)
(1)阻垢剂E的制备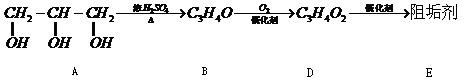
①A可由人类重要的营养物质
 水解制得(填“糖类”、“油脂”或“蛋白质”)
水解制得(填“糖类”、“油脂”或“蛋白质”)
②B与新制的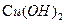 反应生成D,其化学方程式为。
反应生成D,其化学方程式为。
③D经加聚反应生成E,E的结构简式为。
(2)阻垢剂R的制备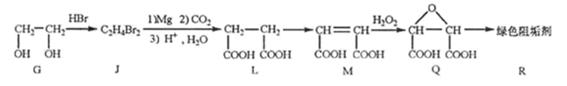
①G→J为取代反应,J的结构简式为。
②由L制备M的反应步骤依次为: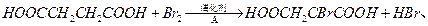
、(用化学方程式表示)。
③1mol Q的同分异构体T(碳链无支链)与足量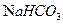 溶液作用产生2mol
溶液作用产生2mol 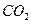 ,T的结构简式为(只写一种)。
,T的结构简式为(只写一种)。