苯甲酸( )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解度 |
| 苯甲酸 |
122 |
1.27 |
249 |
微溶 |
| 乙醇 |
46 |
0.789 |
78.3 |
易溶 |
| 苯甲酸乙酯 |
150 |
1.05 |
212.6 |
难溶 |
实验方案为:


(1)仪器甲的名称为________________。
(2)①往丙中加入药品的顺序为_________________。
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是_____________。
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为_______色。
(3)加入碳酸钠粉末的作用是__________________。
(4)分液要用到的玻璃仪器有__________,粗产物在_______层(填“上”或“下”)。
(5)加热蒸馏若采用下图装置(加热装置已经略去)进行,该装置存在的2个问题为__________、________。

(6)本实验所得到的苯甲酸乙酯产率为______________。
(7)装置乙的作用为____________________
实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: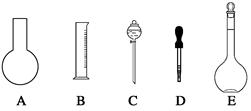
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液需用到的玻璃仪器除上述列出的仪器和玻璃棒外,还需要用到的玻璃仪器是(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度0.8 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,应选用mL量筒最好。
某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。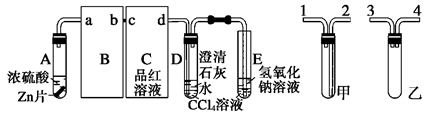
试回答:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:____________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是______________________________________________。
(3) ①能证明浓硫酸具有强氧化性的实验现象为____________________________________;
②反应较长时间后气泡量又会明显增加的原因是_______________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
某研究性学习小组在做Na2O2与水反应实验时,发现向Na2O2与水反应后的溶液中滴加酚酞试液,溶液呈现红色,但红色很快褪去,甲、乙、丙三位同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去.
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大.
丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质.
(1)验证甲同学的推测是否正确的方法是__________________________,验证乙同学的推测是否正确的方法是__________________________________;
(2)有同学提出用定量的方法探究丙同学的推测中是否含有H2O2,其实验方法为:称取2.6 g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论.
①若在标准状况下测量气体的体积,应选用的量筒的大小规格为________(填“100 mL”、“200 mL”、“500 mL”或“1000 mL”).
②若实际测得气体体积小于理论值,试用反应方程式表示Na2O2与水反应的实际过程:。
(9分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。(注意:只要求用原始数据写表达式,不需要化简与计算)
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、电子天平、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(12分)某同学用某种粗盐进行提纯实验,步骤见下图.请回答: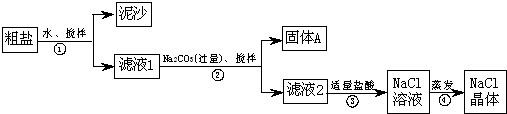
(1)步骤①和②的操作名称是________.
(2)步骤③判断加入盐酸“适量”的方法是__________________________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________________,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含 CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
____________ |
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含 BaCO3 |
取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
___________ |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水,________ |
____________ |
猜想Ⅲ成立 |