下列叙述错误的是( )
| A.氢氧燃料电池是一种将化学能转化为电能的装置 |
| B.铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 |
| C.钢铁腐蚀时负极的电极反应式:Fe-3e-=Fe3+ |
| D.工业上电解饱和食盐水时阴极的电极反应式:2H++2e-=H2↑ |
已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
ΔH=-2 600 kJ·mol-1
②2C6H6(g)+15O2(g)=12CO2(g)+6H2O(l)
ΔH=-6 590 kJ·mol-1
下列说法正确的是()
| A.2 mol C2H2(g)完全燃烧生成气态水时放热大于2 600 kJ |
| B.2 mol C6H6(l)完全燃烧生成液态水时放热大于6 590 kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
下列各组热化学方程式中,Q1<Q2的是()
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1 CH4(g)+3/2O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1 S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1 |
| C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1 |
| D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1 |
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
某一化学反应在不同条件下的能量变化曲线如下图所示。下列说法正确的是()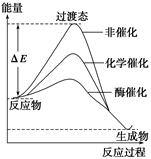
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
下列说法正确的是()
| A.1 L CH3OH蒸汽与1 L水蒸气反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1 mol CH3OH(g)与1 mol H2O(g)的能量总和小于1 mol CO2(g)与3 mol H2(g)的能量总和 |
| D.1 mol CH3OH蒸汽与1 mol液态水反应生成1 mol CO2气体与3 mol氢气吸收的热量小于49.0 kJ |
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是()
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是()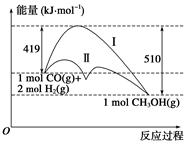
| A.该反应的ΔH=+91 kJ·mol-1 |
| B.加入催化剂,该反应的ΔH变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则ΔH增大 |