将氯水分别滴入下列溶液中,由实验现象得出的结论正确的是( )
| 选项 |
氯水滴入下列溶液中 |
实验现象 |
结论 |
| A |
滴有KSCN的FeCl2溶液 |
变红 |
Cl2具有还原性 |
| B |
滴有酚酞的NaOH溶液 |
褪色 |
Cl2具有酸性 |
| C |
紫色石蕊溶液 |
先变红后褪色 |
Cl2具有漂白性 |
| D |
淀粉—KI溶液 |
变蓝色 |
Cl2具有氧化性 |
2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的45Fe原子,有关45Fe的说法正确的是()
| A.它是一种新元素 | B.45Fe与56Fe 互为同素异形体 |
| C.它是一种新原子 | D.45Fe的中子数是26 |
物质发生化学反应时,下列量值在反应前后肯定不发生变化的是( )
| A.物质的种类 | B.原子总数 |
| C.分子总数 | D.物质所具有的总能量 |
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g)ΔH>0,
P(g)+Q(g)ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为(填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。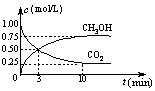
①从3 min到10 min,v(H2)=mol/(L·min)。
②能说明上述反应达到平衡状态的是(选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是(选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
25.用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2溶液体积(V)间的关系图正确的是
为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:
①加水溶解;②加热蒸发结晶;③加入过量氯化钡溶液;④加入过量盐酸;⑤加入过量碳酸钾溶液;⑥过滤。下列操作顺序正确的是
| A.①③⑤⑥④② | B.①⑤③④⑥② | C.①③④⑥⑤② | D.①⑤③⑥④② |