亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如右图所示(部分夹持装置略)。已知:
①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO与NO3-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭__________g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。
①NO2溶于水的化学方程式是_________________________。
②使试管中NO2完全被水吸收的操作是______________________________。
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3="==" FeCO3↓+Na2SO4FeCO3+C6H8O7="==" FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O晶体。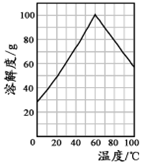
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉
和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| I |
x≥a |
电极附近出现黄色,有气泡产生 |
有Fe3+、有Cl2 |
| II |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有Fe3+、无Cl2 |
| III |
b>x>0 |
无明显变化 |
无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_______。
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式_____。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____性。
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| IV |
a>x≥c |
无明显变化 |
有Cl2 |
| V |
c>x≥b |
无明显变化 |
无Cl2 |
①NaCl溶液的浓度是________mol/L。
②IV中检测Cl2的实验方法:____________________。
③与II对比,得出的结论(写出两点):___________________。
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图1:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B”),再滴加另一反应物.
(2)如图2所示,过滤操作中的一处错误是 .
(3)判断流程中沉淀是否洗净所用的试剂是 .高温焙烧时,用于盛放固体的仪器名称是 .
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用图3装置制备.
装置B中盛放饱和NaCl溶液,该装置的主要作用是 .F中试剂的作用是 .用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 .