金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质。
(1)钠与水反应时,钠漂浮在水面上。甲同学用刺有小孔的铝箔将4.6g的钠包裹,而后投入到水中,使钠沉入水底与水(足量)反应。该过程中发生反应的离子方程式有___________,充分反应生成的气体体积_________(填“大于”、“小于”或“等于”)2.24L(标准状况下)。
(2)乙同学将足量的铜粉投入到500mL18.4mol/L的浓硫酸中并加热制取SO2,写出该反应的化学方程式__________,生成的SO2物质的量小于4.6mol的原因是_____________。
(3)丙同学向MgCl2、AlCl3的混合溶液中逐滴滴加2mol/L的NaOH溶液,并绘制出沉淀与NaOH溶液体积的关系图像如图,则a=_________,b=________。
酸牛奶是人们喜爱的一种营养饮料。酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖。酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为:
工业上它可由乙烯来合成,方法如下: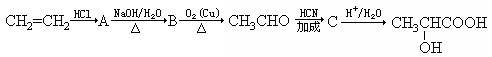
(1)乳酸所含的官能团的名称是。
(2)乳酸自身在不同条件下可形成不同的酯,其酯的式量由小到大的结构简式依次为:
、、。
(3)写出下列转化的化学方程式:A的生成。CH3CHO的生成,C的生成。A→B的反应类型为。
有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示: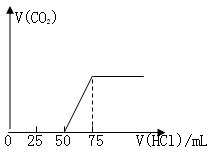
试计算:
(1)向NaOH溶液中通入CO2气体后,所得溶液
中的溶质是,其物质的量之比为。
(2)产生的CO2气体体积(标准状况)是L。
(已知:Na2CO3与HCl反应分步进行,第一步:Na2CO3+HCl=NaHCO3+NaCl;
第二步:NaHCO3+HCl=NaCl +CO2↑+H2O)
取100mL的Na2CO3和Na2SO4混合溶液,加入100 mL Ba(OH)2溶液,恰好完全反应,过滤得到白色沉淀和滤液,沉淀干燥后质量为14.51g。用过量稀盐酸处理上述沉淀,沉淀质量减少到4.66g,并有气体放出。计算:
⑴ 原混合液中Na2SO4的物质的量浓度为mol ·L-1;
⑵ 过滤出沉淀后,所得滤液的物质的量浓度为mol ·L-1(设反应前后溶液的密度均为1g·cm-3,且反应前后溶液体积变化忽略不计);
⑶在处理沉淀时产生的气体在标准状况下的体积为L。
下图所涉及的物质均为中学化学中的常见物质,其中:①C、D、E、F都为单质,其余为化合物;②C、D、E 在常温下为气体,其它物质为固体或液体;③A、I 两种化合物的焰色反应分别为紫色和黄色;④反应①、②中的一些生成物已经略去,有些反应的条件未列出,它们存在如下转化关系。
⑴ 写出有关物质的化学式:
A,D,F,I。
⑵ 指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。
⑶ 写出B与MnO2共热获得D的化学方程式____________________________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: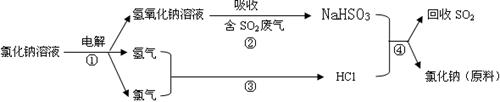
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④_____________________________________。