设NA为阿伏加德罗常数的值。下列说法正确的是
| A.46g乙醇中含有的C—H键的数目为6NA |
| B.0.lmol丙烯酸中含有的双键的数目为0.lNA |
| C.1mol甲基(—CH3)中含有的电子总数为9NA |
| D.标准状况下,22.4L己烷完全燃烧生成的CO2分子的数目约为6NA |
已知离子方程式:As2S3+H2O+NO3—―→AsO43—+SO42—+NO↑+______K(未配平),下列说法错误的是( )。
| A.配平后水的化学计量数为4 |
| B.反应后溶液呈酸性 |
| C.配平后氧化剂与还原剂的物质的量之比为3∶28 |
| D.氧化产物为AsO43—和SO42— |
氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3―→bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是 ( )。
| A.由反应可确定氧化性:HClO3>O2 |
| B.由非金属性:Cl>S,可推知酸性:HClO3>H2SO4 |
| C.若氯酸分解所得1 mol混合气体的质量为45 g,则反应的化学方程式可表示为3HClO3===2O2↑+Cl2↑+HClO4+H2O |
| D.若化学计量数a=8,b=3,则生成3 mol O2时该反应转移20 mol电子 |
硫氰(SCN)2的化学性质和卤素(X2)类似,称为拟卤素,如(SCN)2+H2O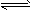 HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是()
HSCN+HSCNO,它们阴离子的还原性强弱为Cl-<Br-<SCN-<I-,下列说法不正确的是()
| A.Cl2可以与KSCN溶液反应 |
| B.(SCN)2可以与KI溶液反应 |
| C.KSCN溶液可以与FeCl3溶液反应 |
| D.(SCN)2可以与KBr溶液反应 |
锰酸钾可用于油脂、纤维、皮革的漂白等,其可由KOH、KClO3和MnO2经共熔制备,反应原理为6KOH+KClO3+3MnO2 KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
| A.KOH和KCl中均含有共价键 |
| B.MnO2在反应中被还原 |
| C.K2MnO4的氧化性大于KClO3 |
| D.该反应中,每生成3 mol K2MnO4转移的电子数为6×6.02×1023 |
有如下变化:A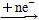 An- ΔH1<0,B
An- ΔH1<0,B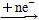 Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
Bn- ΔH2<0,且ΔH1<ΔH2。下列说法中正确的是( )。
| A.氧化性:A<B | B.还原性:An-<Bn- |
| C.稳定性:B<A | D.稳定性:An-<Bn- |