关于制备Fe(OH)3胶体的操作方法正确的是( )
| A.在FeCl3溶液中加入NaOH溶液 | B.加热煮沸FeCl3溶液 |
| C.把FeCl3溶液滴入沸水中 | D.把饱和的FeCl3溶液滴入到沸水中 |
一定量的镁溶于一定浓度的硝酸的反应中,产生标准状况下的N2O气体11.2L,在所得的溶液中加入适量的氢氧化钠溶液,完全反应后过滤出沉淀,经洗涤、蒸干并充分燃烧,最后得到固体物质的质量为( )
| A. 20g | B. 40g | C. 58g | D. 80g |
药物可以预防、诊断和治疗疾病,而中学化学中不少常用化学试剂本身就具
有药物的功效,如酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示。下列对该有效成分的说法正确的是()
| A.所有原子可能共平面 |
| B.能发生加聚反应生成高分子化合物 |
| C.酚酞的水解产物中含有醇羟基 |
| D.1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7K2=5.6×l0–11 |
则下列有关说法正确的是()
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B、将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
C、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D、NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq) △H,某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是()
I3-(aq) △H,某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是()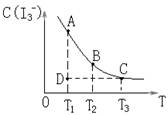
A.反应 I2(aq)+I-(aq) I3-(aq) △H的△H>0 I3-(aq) △H的△H>0 |
| B.若温度为T1、T2时,反应平衡常数分别为K1、K2,则K2>K1 |
| C.若反应进行到状态D时,一定有v正>v逆 |
| D.状态A与状态B相比,状态A的c(I2)大 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是()
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.正极上发生的反应是:O2+4e-+2H2O=4OH- |
| D.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O |