明胶是水溶性蛋白质混合物,溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到_________现象。
(2)Na2CrO4是工业中常用的氧化剂,工业上可用FeCr2O4(Cr元素的化合价为+3)制Na2CrO4,其反应为4FeCr2O4+8Na2CO3+7O2==8Na2CrO4+2Fe2O3+8CO2。
①FeCr2O4中铁元素的化合价为_______,用氧化物的形式表示FeCr2O4的化学式:________。
②该反应的氧化产物是________;每生成1mol Na2CrO4时,转移电子_____mol。
(14分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应
6NO2+ 8NH3 7N2+12
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
(2)已知:2SO2(g)+O2 (g)
(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
①写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明 反应达到平衡状态的是。
反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。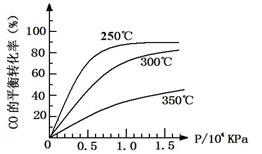
该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
(12分)如图甲、乙是电化学实验装置.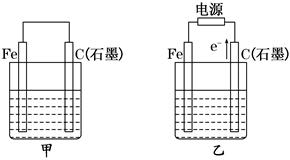
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_______________________________________;
②乙中总反应的离子方程式为_____________________________________ ____;
____;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为___________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________ g。
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):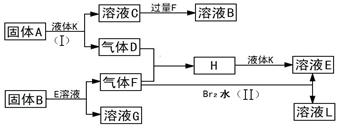
试回答:
(1)甲元素的名称为,溴元素在周期表的位置丁元素的阴离子结构示意图为。
(2)A的电子式为;所含化学键类型为。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)。
(4)反应(I)的化学方程式为。
(5)反应(II)的离子方程式为。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴海水中含有大量的氯化钠。请写出氯离子结构示意图。
⑵目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
⑶工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为;电解时与电源正极相连的电极上产生的气体是,常用检验该气体。
⑷洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况。
②漂白粉的有效成分是(填化学式)。
⑸某NaCl溶液物质的量浓度为a mol·L-1,对应溶液中溶质的质量分数为ω1;若物质的量浓度为b mol·L-1,则对应溶液中溶质的质量分数为ω2;假如b="=" 2 a,则ω22ω1(填:大于、小于、等于)
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
⑴取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
⑵继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
⑶取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有,一定不含有,可能含有。
⑷检验可能含有的物质是否存在的实验方法。