氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原法CCl4法制备氯仿,装置示意图及有关数据如下:

| 物质 |
相对分子质量 |
密度/(g/mL) |
沸点/℃ |
水中溶解性 |
| CHCl3 |
119.5 |
1.50 |
61.3 |
难溶 |
| CCl4 |
154 |
1.59 |
76.7 |
难溶 |
实验步骤:
①检验装置气密性;②开始通入H2;③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl4固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g。请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为 。
(2)B处中发生主要反应的化学方程式为 。
(3)C处中应选用的冷凝管为 (填选项字母);冷水应从该冷凝管的 (填“a”或“b”)口接入。

(4)步骤⑥中,用水洗涤的目的为 。
(5)该实验中,氯仿的产率为 。
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为 。
某小组通过实验研究Na2O2与水的反应。
(1)Na2O2与水反应的化学方程式是。
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂(填化学式),有气体产生。
Ⅱ.乙同学查阅资料获悉:用KMnO4(被还原为 )可以测定H2O2的含量。
)可以测定H2O2的含量。
取3mL溶液a稀释至15mL,用稀H2SO4酸化,再逐滴加入0.0045 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液。
KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液。
①KMnO4与H2O2反应的离子方程式是。
②溶液a中 。
。
③溶液褪色速率开始较慢后变快的原因可能是。
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅰ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色,该过程无明显热效应。
NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色,该过程无明显热效应。
Ⅱ.向0.1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化。从实验Ⅰ和Ⅱ中,可得出的结论是。
NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化。从实验Ⅰ和Ⅱ中,可得出的结论是。
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是。
(2)将a中的溶液加热至100 ℃,从b中缓缓滴加40 g苯乙腈( )到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称是,反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称是,反应结束后加适量冷水,再分离出苯乙酸( )粗品。加人冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
)粗品。加人冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
A 分液漏斗B漏斗C烧杯D.直形冷凝管E.玻璃棒
(3)提纯粗苯乙酸的方法是,最终得到44 g纯品,则苯乙酸()的产率是。
(4)用CuCl2 • 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是。
现有镁条、铝粉、铜片、氧化铝、氧化铁、氯酸钾及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证铝、铁金属单质的还原性强弱。依据你设计的实验方案,回答下列问题:
(1)实验原理:(用化学方程式表示);实验中所需的化学仪器为。
(2)引发实验的操作方法为:。
(3)实验探究:取少量反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,(填能或否)说明固体混合物中无Fe2O3,并说明理由(理由用离子方程式说明)。
根据下图回答问题: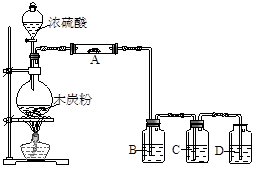
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,观察不到明显的现象,可以用一种简单的方法证明该装置不漏气,其方法和现象是证明该装置不漏气。
(2)烧瓶中发生反应的化学方程式为:。
(3)欲用图中的装置检验上述反应的全部产物。①仪器A要检验产物中的水,则A中的固体是;②B中装入品红溶液,目的是检验;③D中装入澄清石灰水以检验产物中的CO2,要使其它气体不干扰D中CO2的检验,则C中应装入的溶液是。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: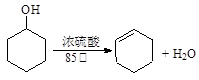 ;
;
反应物和生成物的物理性质如下表:
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环已醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环已烯 |
0.81 |
-103 |
83 |
难溶于水 |
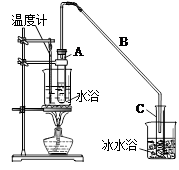
制备粗品:将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入
饱和食盐水,振荡、静置、分层,环己烯在层(填上
或下),分液后用(填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从(填字母)口进入;蒸馏时要加入生石灰的目的。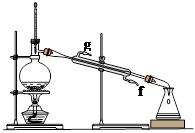
③上图蒸馏装置收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是:a.蒸馏时从70℃开始收集产品;b.环己醇实际用量多了;c.制备粗品时环己醇随产品一起蒸出;d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是。