科学家利用“组合转化”等技术对CO2进行综合利用。如用H2和CO2在一定条件下可以合成乙烯:6H2 (g) +2 CO2 (g) CH2=CH2 (g) +4H2O (g) △H="a" kJ/mol
CH2=CH2 (g) +4H2O (g) △H="a" kJ/mol
(1)己知:①H2和CH2=CH2的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O (g)=H2O(1) △H="=-" 44 kJ/mol,则a="________" kJ/mol
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是________ (填序号)。
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为3:1的H2和CO2,则图中M点时,产物CH2=CH2的体积分数为________;若要进一步提高乙烯的体积分数,可采取的措施有________。
(4)科学家开发了一种新型陶瓷(主要成分为Li4SiO4 ),在500℃时可高效吸收CO2,同时生成Li2CO3;该材料在700℃时可再生循环。请写出表示该过程的化学方程式________。
(5)利用高温电解技术可将CO2转化为高热值的燃料CO:
①电极a发生________ (填“氧化”或“还原”)反应。
②高温电解的总反应的化学方程式为________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)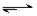 CO2(g)+H2(g)△H<0试回答下列问题:
CO2(g)+H2(g)△H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是。
(3)若降低温度,该反应的K值将,该反应的化学反应速率将(均填“增大”“减小”或“不变”)。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-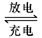 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)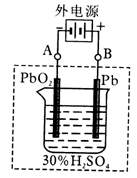
(1)放电时:正极的电极反应式是,电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
如图为以惰性电极进行电解: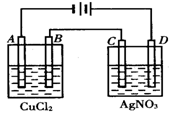
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:________________________________,B:________________________________,
总反应方程式:________________________。
C:________________________________, D:________________________________,
总反应方程式:___________________________。
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
将0.1mol的铁铝混合物溶于100mL 2mol/L硫酸溶液中,然后再滴加1mol/LNaOH溶液。请回答: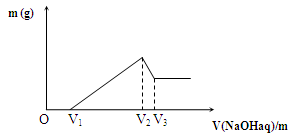
(1) 若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。最初加入V1mLNaOH溶液的作用是_________________________;
(2)若在滴加NaOH溶液过程中,欲使Fe2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL。
(3)若V1=160mL,则金属混合物中n(Fe)=mol V3=mL;(写出第(2)题的解题过程)