某工厂生产了一种加酶洗衣粉,其包装袋上印有如图1说明(部分).

某研究性学习小组为探索该洗衣粉中酶催化作用的最适温度,设计了如图2装置进行实验,并将实验结果用曲线图3表示.
(1)由曲线图可知,该洗衣粉中的酶在45℃时活性最佳,但当把洗衣粉溶液从75℃降温到45℃时,酶的催化能力已不能恢复,这是因为 .
(2)该加酶洗衣粉不能用于洗涤丝质及羊毛衣料,其主要原因是 .
根据下表所给的原子结构示意图,回答有关内容(其中“元素类别”指金属元素、非金属元素或稀有气体元素)
| 原子结构示意图 |
元素符号 |
质子数 |
电子层数 |
最外层电子数 |
元素类别 |
如右图所示,在小烧杯A中装入30ml蒸馏水,再滴入3滴酚酞,在小烧杯B中装入300ml浓氨水,用一大烧杯把A、B两个烧杯罩在一起,过一段时间看到的现象是 ,该实验说明 。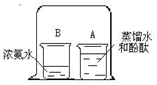
一些同学对上述结论有不同看法,主要有以下两种猜测:
第一种:B烧杯中的蒸馏水使酚酞试液变红
第二种:B烧杯中的浓氨水挥发出氨气,扩散到A烧杯中的溶液中使酚酞试液变红。
①你认为 猜测正确。
②为证明这两种猜测,现设计如下实验:(请完成下空)
| 实验内容、方法 |
现象 |
结论 |
| 用洁净的水烧杯取30ml水,滴入2-3滴酚酞试液,观察现象 |
不变色 |
水 使酚酞变色(填“能”或“不能”,下同) |
| 取一张滤纸,滴上酚酞试液,待晾干后,放在装有浓氨水的试剂瓶上方 |
酚酞不变色 |
氨气 使酚酞变色 |
| 将少量氨气通入含有酚酞试液的蒸馏水中 |
溶液变 色 |
氨气溶解水中形成的氨水能使酚酞变色 |
A、B、C三种元素的粒子结构示意图如下图所示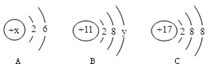
(1)当A、B为原子时,X= ;Y= ;
(2)C表示的粒子符号是 ,该元素与B元素形成的化合物是由 (填“分子”、“原子”、“离子”)构成的。
元素周期表是学习和研究化学的重要工具.请分析表中信息回答有关问题:
(1)表中最(1)表中8号元素的一个原子在化学反应中易得到 个电子;11号元素易失去电子,其形成离子的符号是 ;日本福岛核电站核泄漏中具有放射性的原子主要是碘-131,请根据右图推断碘在周期表中位于第 周期。
(2)分析表中信息,你能得出的规律是:
横行规律(任写一条) ,
纵行规律(任写一条) 。
如右图所示,把分别充满红棕色二氧化氮(NO2)所体和无色氢气(H2)的集气瓶中间的玻璃片抽走,使两瓶口密合在一起(不要振荡),可观察到A中的两瓶气体的颜色很快趋于一致(两种气体不反应),而B中需很长时间才能达到同样效果。观察,对比实验,你能得出的结论有:
(1) ;
(2) ;