下列离子方程式正确的是
| A.铁和稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| B.氯气和溴化钠溶液反应:C12+2Br-→2C1—+Br2 |
| C.氢氧化钡和稀硫酸反应:SO42-+Ba2+→BaSO4↓ |
| D.醋酸和碳酸钙反应:2H++CaCO3 →Ca2++CO2↑+H2O |
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法中正确的是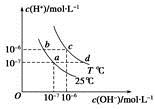
| A.若从a点到c点,可采用在水中加入酸的方法 |
| B.b点对应的醋酸中由水电离的c(H+)=10-6mol·L-1 |
| C.c点对应溶液的Kw大于d点对应溶液的Kw |
| D.T ℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是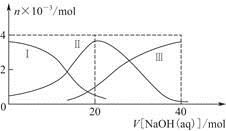
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(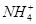 )/c(NH3·H2O)的值增大 )/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 |
c(HA)/mol·L-1 |
c(NaOH)/mol·L-1 |
混合溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.2 |
0.2 |
pH=9 |
| 丙 |
c1 |
0.2 |
pH=7 |
| 丁 |
0.2 |
0.1 |
pH<7 |
下列判断正确的是
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
C.c1<0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)