硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):4FeS2+11O2→2Fe2O3+8SO2
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 。
(2)设1t纯净的FeS2完全反应,产生标准状况下SO2 m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3="=" NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 ="=" 2NaNO2 + CO2↑ ②
⑴配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2Og;
⑵现有1000g质量分数为21.2%的纯碱吸收液,在20℃经充分吸收硝酸工业尾气后,测得吸收液中NaNO2和NaNO3物质的量之比为5:3(不考虑NO、 NO2与水的反应),
① 硝酸工业尾气中NO、 NO2的物质的量之比为;
② 若将反应后的溶液,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
某气态烷烃和乙烯等体积混合时,1体积混合气体完全燃烧消耗同温同压下4.75体积氧气。试回答:
(1)该烷烃的分子式为;
(2)该烷烃所有同分异构体的结构简式为。
(12分)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是,原因是。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为,分子的空间构型为。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为。
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g)+1/2O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。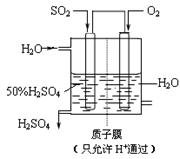
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正)v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为。
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为
____________。
(共8′)
现有浓度为0.1 mol·L-1的五种电解质溶液① Na2CO3、② NaHCO3、③ NaAlO2
④ CH3COONa、⑤NaOH。已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-,试回答:
(1)这五种溶液的pH由大到小的顺序是
(用编号填写,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是________;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式。