下列说法正确的是( )
| A.氧化还原反应中一定有电子得失 |
| B.凡是能电离出H+的化合物均属于酸 |
| C.离子反应不一定是氧化还原反应 |
| D.置换反应不一定是氧化还原反应 |
56gFe粉投入500g稀HNO3中,两者恰好完全反应放出NO,溶液增重26g,则反应后溶液中的金属阳离子
| A.只有Fe3+ | B.只有Fe2+ | C.有Fe2+和Fe3+ | D.无法确定 |
下列离子方程式书写正确的是
| A.用氨水吸收少量SO2:NH3·H2O + SO2 = NH4+ + HSO3- |
B.用两个铜片作电极电解盐酸: |
| C.含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl- |
| D.碳酸氢钙溶液中加入足量烧碱溶液:HCO3- + OH- = CO32- + H2O |
根据实验目的判断下列实验操作或装置正确的是
| 目的 |
实验室制O2 |
配制稀硫酸溶液 |
在铁制品上镀铜 |
净化、精制淀粉胶体 |
| 装置 或 操作 |
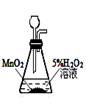 |
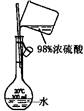 |
 |
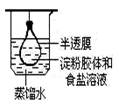 |
| 选项 |
A |
B |
C |
D |
下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、MnO4-、SO42-②pH=11的溶液中:CO32-、Na+、NO3-、AlO2-
③加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤在溶液中能大量共存,加入NaOH后加热既有气体放出又有沉淀生成的溶液:
Ca2+、HCO3-、NH4+、AlO2-
⑥能使酚酞变红色的溶液:Na+、C1-、S2-、SO32-
| A.①③⑤ | B.②④⑤ | C.②④⑥ | D.④⑤⑥ |
下列判断错误的是()
| A.酸性:HClO4>H2SO4>H3PO4 | B.热稳定性:NH3>PH3>AsH3 |
| C.碱性:NaOH >Mg(OH)2>Al(OH)3 | D.熔点:SiO2> CCl4> NaCl |