下列离子方程式书写正确的是
| A.金属铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| B.稀硫酸与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
C.氯气与水反应:H2O+Cl2 2H++Cl-+ClO- 2H++Cl-+ClO- |
| D.氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
下列条件下,两瓶气体所含原子数、分子数一定相等的是()
| A.同质量、不同密度的N2和CO | B.同密度、同体积的H2和N2、、 |
| C.同体积、同密度的C2H4和C3H6 | D.同温度、同体积的N2O和CO2 |
下列实验操作中,一般情况下不应该相互接触的是 ()
| A.用胶头滴管向试管中滴液体时,滴管尖端与试管内壁 |
| B.向容量瓶中转移液体时,使用的玻璃棒与容量瓶颈内壁 |
| C.过滤操作中,漏斗末端与承接滤液的烧杯内壁 |
| D.实验室将HCl气体溶于水时,漏斗口与水面 |
下列叙述正确的是( )
| A.元素的单质可由氧化或还原含该元素的化合物来制得 |
| B.得电子越多的氧化剂,其氧化性就越强 |
| C.阳离子只能得到电子被还原,只能做氧化剂 |
| D.含有最高价元素的化合物一定具有强的氧化性 |
采用NH3作还原剂,除去烟气中的氮氧化物,反应原理为:NO(g) + NO2(g) + 2NH3(g)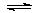 2N2(g) + 3H2O(g)。下图是烟气以固定的流速通过两种不同催化剂①和②时,测量相同时间得到的烟气脱氮率图像。根据该图像,下列说法中正确的是
2N2(g) + 3H2O(g)。下图是烟气以固定的流速通过两种不同催化剂①和②时,测量相同时间得到的烟气脱氮率图像。根据该图像,下列说法中正确的是
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450℃左右脱氮 |
| C.催化剂②比①脱氮效果好,说明催化剂②能导致该反应平衡向右移动程度更大 |
| D.相同条件下,改变压强对脱氮率没有影响 |
常温下两种溶液:①1mol·L-1的Na2CO3溶液,②1mol·L-1的NaHCO3溶液。下列对于这两种溶液的说法正确的是
| A.两种溶液中都存在:c(H+)·c(OH-)=1×10—14 |
| B.c(H2CO3):①>② |
| C.两种溶液中都存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| D.向②溶液中加入等体积的1mol·L-1的NaOH溶液,②溶液可以变成①溶液 |