锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,锌失去电子,电解液内部OH-向负极移动 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
下列有关反应能量变化图像的判断错误的是
| A.I可表示需加热的放热反应 | B.Ⅱ可表示需加热的放热反应 |
| C.Ⅲ可表示爆炸反应 | D.Ⅳ可表示酸和碱的中和反应 |
一定温度下,向质量分数为a的乙腈(CH3CN)溶液中加入等体积水,所得溶液中乙腈质量分数为0.4a,则乙腈的密度(ρ1)与水的密度(ρ2)的关系是
| A.ρ1>ρ2 | B.ρ1=ρ2 | C.ρ1<ρ2 | D.无法确定 |
某气态化合物X含C.H.O三种元素,已知下列条件:(1) X中C的质量分数;(2) X中H的质量分数;(3) X在标况下的体积;(4) X对H2的相对密度;(5) X的质量。欲确定化合物X的分子式,所需的最少条件是
A.(1) (2) (4) B.(2) (3) (4) C.(1) (3) (5) D.(1) (2)
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9 ,单质Y可与NaOH溶液反应生成氢气。下列说法不正确的是
| A.原子半径:Y>Z>W |
| B.XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体 |
C.YW3水溶液蒸干并灼烧可得固体YW3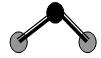 |
| D.ZW2分子结构见上图,说明ZW2是极性分子 |
向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色透明溶液。下列对此现象的相关说法不正确的是
| A.沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ |
| B.向反应后的溶液中加入乙醇,有沉淀析出 |
| C.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 |
| D.反应前后,Cu2+浓度不变 |