取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是( )
| A.1mol/L | B.2mol/L | C.3mol/L | D.4mol/L |
下列离子方程式正确的是()
| A.NaHCO3溶液和NaOH溶液混合HCO3-+OH- |
| B.将少量的二氧化硫气体通入氯化钙溶液中SO2+H2O+Ca2+ |
| C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O |
| D.铜片与稀HNO3反应:3Cu+2NO3-+8H+ |
下列化学用语表示正确的是()
A.氯化钠的电子式为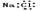 |
B.次氯酸的电子式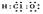 |
| C.二氧化碳的结构式为O=C=O |
| D.NaHCO3的电离方程式为NaHCO3=Na++H++CO32- |
下列叙述正确的是()
| A.18gD2O中含有的质子数为10×6.02×1023个 |
| B.1mol碳正离子(CH5+)中含电子数为10×6.02×1023个 |
| C.44gC3H8分子中含共价键数为11×6.02×1023个 |
| D.1Lmol·L-1醋酸溶液中离子总数为2×6.02×1023个 |
下列各组离子能在指定溶液中肯定大量共存的是()
①无色溶液中:K+、Na+、Cu2+、Cl-、SO42-
②pH>7的溶液中:CO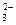 、NO3-、Na+、S2-、AlO2-、SO32-
、NO3-、Na+、S2-、AlO2-、SO32-
③水电离出的c(H+)=10-12mol·L-1的溶液中:HCO3-、NO3-、NH4+、Fe2+
④加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、CO32-
⑤pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
| A.②③④ | B.①④⑤ | C.②⑤ | D.③⑤ |
某些毛绒玩具的内充物为无毒的聚酯纤维,其结构简式为:
|
下列说法正确的是()
| A.羊毛与聚酯纤维的化学成分相同 |
| B.聚酯纤维在强碱溶液中能水解 |
| C.合成聚酯纤维的反应属于加聚反应 |
| D.聚酯纤维可以认为是苯甲酸和乙醇经酯化反应生成 |