要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A.加入氯水振荡,观察水层是否有红棕色出现 |
| B.滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成 |
| C.取少许,加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
| D.加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A
B.A与E形成的化合物是离子化合物
C.B与E可以形成EB2型化合物
D.最高价氧化物对应的水化物碱性:C<D
山梨酸是一种常见的食物添加剂,它是一种无色针状晶体或白色粉末,它的结构简式为
CH3—CH=CH—CH=CH—COOH。下列关于山梨酸的叙述不正确的是
| A.山梨酸易溶于四氯化碳 |
| B.山梨酸能与氢气发生加成反应 |
| C.山梨酸能和乙醇反应生成酯 |
| D.1 mol山梨酸能和金属钠反应生成1 mol氢气 |
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,并向a中加入少量CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是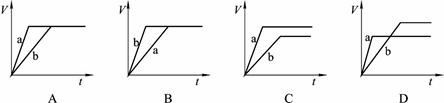
下列离子方程式正确的是
| A.把少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-= 2HClO+CaSO3↓ |
| B.足量铁屑溶于稀硫酸:2Fe+6H+=2Fe3++3H2↑ |
| C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O |
| D.铝片溶于烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
镭是元素周期表中第7周期第IIA族元素,下列有关叙述不正确的是
| A.镭的金属性比钙弱 | B.单质能与水反应生成H2 |
| C.镭在化合物中呈+2价 | D.碳酸镭难溶于水 |