ClO2是一种消毒杀菌效率高,二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
| A.1mol KClO3参加反应有2mol电子转移 | B.H2C2O4在反应中被还原 |
| C.还原性:H2C2O4 > ClO2 | D.ClO2是氧化产物 |
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法错误的是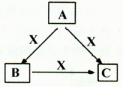
A.若X为O2,则A可为硫化氢
B.若X为KOH溶液,则A可能为AlCl3
C.若X为Fe,则C可能为Fe(NO3)2
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为Na
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列选项正确的是:
| A.元素非金属性:Z>Y>X | B.气态氢化物的稳定性:Z<Y<X |
| C.原子半径:Z<Y<X | D.最高价氧化物对应水化物的酸性:Z>Y |
下列各组物质相互混合反应后,最终有白色沉淀生成的是:
①金属钠投入到FeCl2溶液中; ②过量NaOH溶液和明矾溶液混合;
③少量Ca(OH)2投入过量NaHCO3溶液中; ④向NaAlO2溶液中通入过量CO2 ;
⑤向饱和Na2CO3溶液中通入过量CO2 ; ⑥向水玻璃溶液中加入过量盐酸。
| A.①③④⑤ | B.③④⑤⑥ | C.②③⑥ | D.①④⑥ |
用下图所示装置进行下列实验,能达到实验目的的是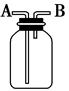
| A.瓶中盛有适量浓H2SO4,从A口进气来干燥NH3 |
| B.从B口进气,用排空气法收集CO2 |
| C.瓶中盛满水,从B口进气,用排水法收集NO2 |
| D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
| A.浓硝酸具有强氧化性,可用铁罐贮运浓硝酸 |
| B.明矾常作为净水剂,双氧水通常可用于作杀菌消毒 |
| C.合成氨工业中通过升高温度可以增大平衡常数K,来提高氨的产率 |
| D.催化剂可以改变反应速率,对平衡移动没有影响 |