FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
有等体积、等物质的量浓度的氢硫酸和亚硫酸溶液各两份,分别通入Cl2和O2,溶液的pH变化(y)与通入气体的量x的关系如图3-6所示,则a、b、c、d分别所代表的pH变化与之对应的化学反应分别是:
图3-6
| A.在氢硫酸中通入O2_________________; |
| B.在亚硫酸中通入O2_________________; |
| C.在氢硫酸中通入Cl2_________________; |
| D.在亚硫酸中通入Cl2_________________。 |
A、B、C三种一元弱酸的浓度均为0.1 mol·L-1,在室温下,A溶液中C(OH-)=7.6×10-12 mol·L-1,B溶液中水电离产生的H+浓度为10-10 mol·L-1,C溶液的pH=3,则三种溶液的酸性由强到弱的顺序是______________________________。
水的电离平衡曲线如图所示:
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH)2与盐酸的体积之比为________________________________。
(3)已知AnBm的离子积=[C(Am+)]n·[C(Bn-)]m,式中的C(Am+)、C(Bn-)表示离子的物质的量浓度。若某温度下CA(OH)2溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积约为_____________________________________________。
在一定温度下,有A.盐酸 b.硫酸 C.醋酸三种酸:
(1)当其物质的量浓度相同时,C(H+)由大到小的顺序是___________________________;
(2)同体积、同物质的量浓度的三种酸,中和NAOH的能力由大到小的顺序是___________;
(3)若三者C(H+)相同时,物质的量浓度由大到小的顺序是_________________________;
(4)当三者C(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_____________________________;
(5)当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________________,反应所需时间的长短关系是_________________________________;
(6)将C(H+)相同的三种酸均加水稀释至原来的100倍后,C(H+)由大到小的顺序是__
______________________________________________。
生活污水中含有大量的有机和无机含氮化合物,这些过量的含氮化合物会造成水体污染,危害水生生物生存和人类的健康。脱氮是污水处理的重要内容之一,其实质是在反应池中,pH为8.0—8.4时,硝化细菌大量繁殖,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应可用下式表示:
□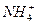 +□O2→□
+□O2→□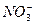 +□H++□H2O
+□H++□H2O
(1)配平上面的离子方程式,将化学计量数填入方框中。
(2)将铵态氮中的1 mg氮转化为硝酸根中的氮,需氧气多少毫克?
(3)为什么在反应中需要不断添加碱?
(4)在另一反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示:
□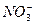 +5CH3OH→□N2↑+□CO2↑+□H2O+□OH-
+5CH3OH→□N2↑+□CO2↑+□H2O+□OH-
配平上面的离子方程式,将化学计量数填入方框中。