(1)在某压强恒定的密闭容器中加入2 molN2和4 molH2发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
①达到平衡时,N2的转化率为___________。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同,则a 、b、c应满足的关系为 。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温度下达到平衡,则平衡时NH3的浓度 (1) (2) (填“>”、“<”或“=”)。
(3)常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10mol/L HCl溶液和20.00 mL 0.10 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:

①NaOH溶液滴定HCl溶液的曲线是 (填“图1”或“图2”);
②图中c(Na+)=c(CH3COO-)的点是 (填A、B、C、D或E);
③滴定结束,经数据处理后发现a大于20.00ml,请你分析该同学测定a值偏大的原因可能是 。
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W |
X |
Y |
Z |
|
| 结构或性质 |
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是(填序号)。
A.自然界中的含量 B.单质与酸反应时失去的电子数
C.单质与水反应的难易程度D.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因:,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有(填序号)。
A.m、n B.m、yC.n、y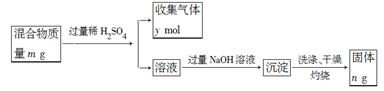
有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的分子量与X最高价氧化物的分子量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子。试回答:
(1)写出各元素符号:X、Y、Z。
(2)X离子的结构示意图为。X与Y形成的离子化合物的电子式为, Z和氢形成的化合物的电子式为。
(3)Y单质在空气中燃烧的化学方程式为,生成物与水反应的化学方程式为。
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: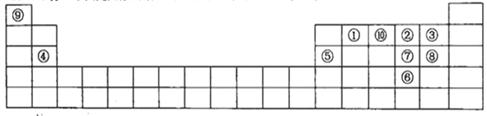
(1)在这10种元素中,非金属性最强的是(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为,元素②与⑨形成的18e-化合物的电子式;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:>(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式。
(6)元素④和③形成的化合物属于化合物,用电子式表示其形成过程。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为,中心原子杂化类型为。
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为(填序号)。
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式。
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。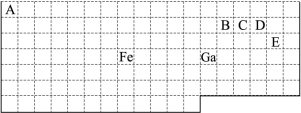
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为。
(2)Fe元素位于周期表的区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为和(填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有。
(4)根据VSEPR理论预测ED4-离子的空间构型为。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为(写2种)。