四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| |
W |
X |
Y |
Z |
| 结构或性质 |
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
A.自然界中的含量 B.单质与酸反应时失去的电子数
C.单质与水反应的难易程度 D.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有 (填序号)。
A.m、n B.m、y C.n、y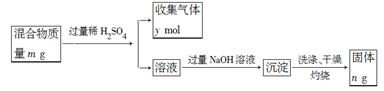
有一个食品广告称:“我公司生产的新型糕点不含糖,是糖尿病人的最佳选择”。下表是其包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品名 |
XXX |
| 配料 |
鲜鸡蛋、精面粉、精炼植物油、碳酸氢钠、甜蜜素、柠檬黄、苯甲酸钠等 |
| 保质期 |
120天 |
| 生产日期 |
标于包装袋封口上 |
(1)富含蛋白质的是________;
(2)富含油脂的是________;
(3)属于防腐剂的是________;
(4)属于着色剂的是________;
(5)属于调味剂的是________;
(6)属于疏松剂的是________;
(7)请分析广告的说法是否科学?____________________________________。
色香味俱佳、口感好的食品深受人们的喜爱。为了提高食品的质量,在生产过程中往往会加入一些能改变食品某些性质的物质(即食品添加剂)。
(1)味精是常用的一种鲜味剂,其有效成分是谷氨酸钠,它的结构简式是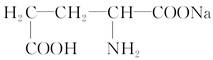 ,该物质分子中所含的官能团有________和________(填写名称)。
,该物质分子中所含的官能团有________和________(填写名称)。
(2)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松。试写出碳酸氢钠受热分解的化学方程式:__________________________________。
据中央电视台新闻报道,某知名品牌保健食品补钙剂经检测,H2O2含量超标,试回答下列问题.
(1)该品牌保健食品属于________的保健食品。
A.强化营养人群
B.特殊人群
C.健康异常人群
(2)试推测该保健食品中钙以________的方式存在。
A.钙单质B.Ca(OH)2 C.CaCO3D.乳酸钙
(3)试写出超标的H2O2的电子式________。
(4)某成年女子,经化验知缺铁,如果该女子也使用补铁保健食品,能否与该品牌保健食品同时食用________,如果不能,试用化学方程式表示其原因__________________________。
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为: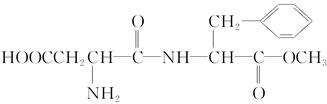
已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如: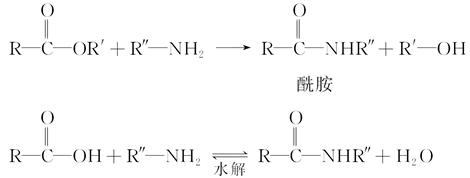
②酯比酰胺容易水解。请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是________和________。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成________、________和________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和________________。(填写结构简式,该分子中除苯环以外,还含有一个六原子组成的环)。
某有机物含碳、氢、氧、氮四种元素。如图是该有机物的球棍模型(其中黑点表示原子,短线表示原子之间的共价键),则该有机物的化学式为________________________。
写出该有机物的一种同分异构体,它的分子中含有两个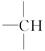 ,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。
,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。