实验室常用MnO2与浓盐酸加热制备Cl2,反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,某小组同学提出的下列实验方案:向足量的二氧化锰中加入12.0mL的浓盐酸,加热,反应结束时收集到336mLCl2(标准状况);将反应后得到的残余液过滤、洗涤滤渣,洗涤液和滤液混合;向滤液中加入足量的AgNO3溶液,过滤、洗涤、干燥后得到固体11.48g。计算
(1)参加反应的二氧化锰的质量。
(2)将生成的Cl2通到NaOH溶液中制得100mL消毒液,求消毒液中有效成分的物质的量浓度。
(3)浓盐酸能和二氧化锰反应的生成Cl2的最低浓度(假设反应后残余液体积为12mL)。(保留至0.01)
已知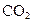 和
和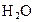 的混合物与
的混合物与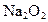 反应时是
反应时是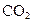 与
与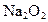 反应完后,
反应完后,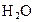 再与
再与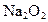 反应.现将a mol的
反应.现将a mol的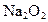 和
和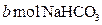 固体混合后,在密闭容器中加热到250℃,让其充分反应,
固体混合后,在密闭容器中加热到250℃,让其充分反应,
(1)当剩余固体为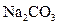 ,排出气体为
,排出气体为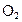 ,
,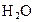 时,
时,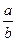 的值为________.
的值为________.
(2)当剩余固体为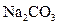 ,NaOH,排出气体为
,NaOH,排出气体为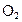 ,
,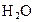 时,
时,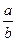 的值为________.
的值为________.
(3)当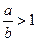 时,剩余固体为________,排出气体为________.
时,剩余固体为________,排出气体为________.
(4)当排出的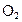 和
和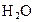 为等物质的量时,则
为等物质的量时,则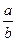 的值为________.
的值为________.
制取4.78kg的普通玻璃(化学式为Na2O·CaO·6SiO2)的同时产生的CO2在标准状况下的体积是多少L?
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点上各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(见图1-25)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。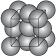
图1-25
(1)金晶体每个晶胞中含有 个金原子。
(2)欲计算一个晶胞的体积,除假定金属原子是刚性小球外,还应假定 。
(3)一个晶胞的体积是 。
(4)金晶体的密度是 。
X、Y、Z、W都是短周期元素,原子半径为W>Z>X>Y。已知:X、Y两元素处于同一周期,X、Z处于周一主族,Z原子核内的质子数等于X、Y原子核内的质子数之和;Z原子最外电子层上的电子数是W原子最外电子层上的电子数的4倍。试回答:
(1)这四种元素单质(若有同素异形体只考虑熔点最高的)的熔点由高到低的顺序是(写化学式) 。
(2)由这四种元素组成的两种正盐的水溶液(均为0.1 mol·L-1)的pH由大到小的顺序是(写化学式) 。
(3)Y和Z两元素可形成化合物ZY2,某种ZY2晶体的结构相当于把金刚石中原子均换成Z原子,再在原两个Z原子连线的中点位置放一个Y原子,则此晶体中由Z、Y原子组成的最小环是 元环,在此最小环上有 个Y原子和 个Z原子。
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点上各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(见图1-25)。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。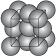
图1-25
(1)金晶体每个晶胞中含有 个金原子。
(2)欲计算一个晶胞的体积,除假定金属原子是刚性小球外,还应假定 。
(3)一个晶胞的体积是 。
(4)金晶体的密度是 。