不能用离子方程式Ba2+ + SO42-=BaSO4↓表示的化学反应有
| A.BaCl2溶液与稀硫酸反应 |
| B.Ba(OH)2溶液与Na2SO4溶液反应 |
| C.Ba(OH)2溶液与NaHSO4溶液反应 |
| D.Ba(NO3)2溶液与MgSO4溶液反应 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向溶液X中先滴加稀盐酸,再滴加Ba(NO3)2溶液 |
出现白色沉淀 |
溶液X中一定含有SO42- |
| B |
混合装有Cl2和NH3两集气瓶中的气体 |
产生大量白烟 |
NH3显还原性和碱性 |
| C |
向硫酸亚铁溶液中加入Na2O2粉末 |
出现红褐色沉淀 |
硫酸亚铁已被空气氧化变质 |
| D |
向滴有甲基橙的AgNO3溶液中滴加KNO3稀溶液 |
溶液由红色变为橙色 |
KNO3溶液具有碱性 |
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2 SO4(s)+SO2(g) [N(CH3)4]2 S2O6(s)
[N(CH3)4]2 S2O6(s)
下列说法正确的是
| A.[N(CH3)4]+中只含σ键 |
| B.该反应中,SO2作氧化剂 |
| C.SO2漂白品红是利用其强氧化性 |
| D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
同位素示踪法可用于反应机理的研究,下列反应中,同位素示踪表示正确的是
| A.CH3COOH+C2H18 5OH→CH3COOC2H5+H18 2O |
B.NH4Cl+2H2O NH3·2H2O+HCl NH3·2H2O+HCl |
| C.K37ClO3+6HCl=K37Cl+3Cl2↑+3 H2O |
| D.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O |
用下图所示装置进行实验,装置正确且设计合理的是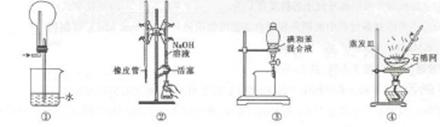
| A.图①所示装置可吸收HCl气休 |
| B.图②所示装置进行用已知浓度的NaOH溶液测定盐酸浓度的实验 |
| C.图③所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口放出 |
| D.图④所示装置蒸发NaCl溶液,得到NaCl固体 |
下列实验操作中,仪器末端应当插入溶液液面以下的是
| A.用水吸收氨气时的导气管 |
| B.石油分馏时测量温度所用的温度汁 |
| C.用乙醇制备乙烯时所用的温度计 |
| D.用NaOH溶液和Fe2(SO4)3溶液制备Fe(OH)3、时,吸有NaOH溶液的胶头滴管 |