可逆反应2SO2 (g)+ O2 (g) 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
下列溶液中可能大量共存的离子组是 ()
| A.由水电离出c(H+)=10-12 mol·L-1的溶液:K+、Al3+、Cl-、SO42- |
| B.在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
| C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- |
| D.含大量Al3+的溶液:K+、Ca2+、Cl-、HCO3- |
下列关于化学反应的自发性叙述中正确的是( )
| A.焓变小于零而熵变大于零的反应肯定是自发的 |
| B.焓变和熵变都小于零的反应肯定是自发的 |
| C.焓变和熵变都大于零的反应肯定是自发的 |
| D.熵变小于零而焓变大于零的反应肯定是自发的 |
下列措施或事实能用勒沙特列原理解释的是( )
| A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成 |
| B.H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 |
| C.钢铁在潮湿的空气中更容易生锈 |
| D.氯气可以用排饱和食盐水的方法收集 |
对于反应A + B = C,下列条件的改变一定使化学反应速率加快的是( )
| A.升高体系的温度 | B.增加体系的压强 |
| C.增大C的物质的量浓度 | D.增加A的物质的量 |
将NaCl溶液在一块光亮的清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区是液滴之下氧气会含量比边缘少。下列说法正确的是 ( )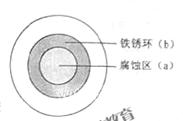
| A.液滴中的Cl-由a 区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-==4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a 区向b区迁移,在b区形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaC1溶液,则负极发生的电极反应为:Cu-2e-="=" Cu2+ |