获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是
| A.该电池负极的电极反应为:Al﹣3e﹣═Al3+ |
| B.电池工作时,溶液中的铝离子向正极移动 |
| C.该电池可能是一种可充电的二次电池 |
| D.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 |
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。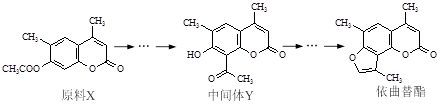
下列说法正确的是
| A.原料X与中间体Y互为同分异构体 |
| B.原料X可以使酸性KMnO4溶液褪色 |
| C.中间体Y能发生加成、取代、消去反应 |
| D.1 mol依曲替酯只能与1 mol NaOH发生反应 |
下列有关说法正确的是
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw减小 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |
下列表示对应化学反应的离子方程式正确的是
| A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O |
| B.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ |
| C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O |
| D.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L水中所含电子总数为NA |
| B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA |
| C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是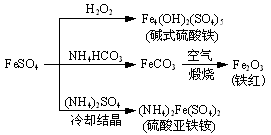
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |