(1)室温下,有一pH=12的NaOH溶液100mL,欲使它的pH降为11。
①如果加入蒸馏水,就加入________mL
②如果加入pH=10的NaOH溶液,应加入_________mL
③如果加入0.008mol/LHCl溶液,应加入__________mL
(2)实验室在配制溶液时,一些物质存在水解的情况,如在配制Na2CO3溶液时,CO32-会水解,请书写水解离子方程式,在配制Al2(SO4)3溶液时,Al3+也存在水解,请书写水解离子方程式,为了防止Al2(SO4)3发生水解,可加入少量的。
(3)工业上用氧化铜制备氯化铜时,先将制的氧化铜(含有杂质FeO)用浓酸溶解得到的氯化铜(溶液中含有一定量的Fe2+)。
| 金属离子 |
pH值 |
|
| 开始沉淀 |
完全沉淀 |
|
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.4 |
6.4 |
| Fe3+ |
2.7 |
3.7 |
实际生产中先用次氯酸钠将Fe2+氧化成Fe3+,然后用试剂将溶液pH值调至 ~ ,即可除去铁杂质。
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。请回答下列相关问题:
(1)Cu的核外电子排布式为。
(2)N的L层中有对成对电子;N 立体构型是,其中心原子的杂化方式为。
立体构型是,其中心原子的杂化方式为。
(3)氨水溶液中存在多种氢键,任表示出其中两种;
(4)[Cu(NH3)4]SO4·H2O中呈深蓝色的离子是,该微粒中的“电子对给予一接受键”属于键;
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式。
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式、;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形;
、④HCHO,其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiOFeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为;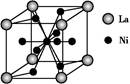
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为。
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)。
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是。
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是。
(6)如图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为。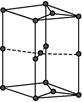
物质的转化关系如图所示(有的反应可能在水溶液中进行)。其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成。请回答下列问题:
(1)写出甲的电子式:。
(2)写出反应Ⅰ的化学方程式:。
(3)A溶于水得到溶液X,在25 ℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为,
用含a和b的代数式表示出该混合溶液中X的电离平衡常数。
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过如图装置处理污水。
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ.;Ⅱ.。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分Y物质参加循环(见上图)。Y物质的化学式是。
如图表示常见元素单质及化合物相应关系,某些生成物已略去。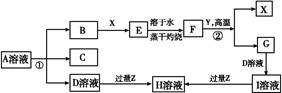
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分。请回答下列问题:
(1)D的电子式;H为(填化学式)。
(2)完成下列方程式:
①空气中含量最高的气体与C反应的化学反应方程式;
②反应②的化学反应方程式;
③足量B通入H溶液的离子反应方程式。