NaCl、CaCl 2的部分溶解度数据见下表。
温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
溶解度 (g/100g水) |
NaCl |
36.0 |
36.6 |
37.1 |
38.0 |
39.2 |
CaCl 2 |
27.6 |
39.8 |
41.4 |
43.2 |
45.2 |
|
①由上表可知:20℃时,NaCl的溶解度是 g/100g水;60℃时,溶解度相对较大的物质是 。
②某NaCl固体中含有CaCl 2杂质,分别取样进行实验。
【测定杂质含量】
取10.0g样品溶于水,加入足量Na 2CO 3溶液,与CaCl 2反应生成NaCl和0.01mol CaCO 3沉淀,计算样品中CaCl 2的质量。(根据化学方程式列式计算) 。
【提纯NaCl】取30g样品,依据两种物质的溶解度差异设计实验并提纯NaCl。

Ⅰ.溶液A是NaCl的 (选填"饱和"或"不饱和")溶液;
Ⅱ.溶液A中CaCl 2的质量分数 (选填"大于""小于"或"等于")溶液B中CaCl 2的质量分数;
Ⅲ.为达成实验目的,上述三个步骤在试剂用量、实验操作等方面都有综合考虑,请写出其设计意图 。
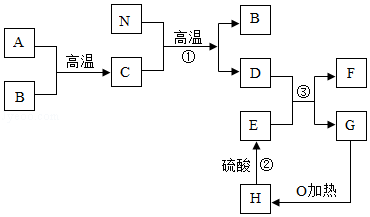
如图中各物质均为初中化学常见物质,其中A为黑色非金属单质,D、G为金属单质且G为紫红色,B是导致温室效应的主要气体,C是一种有毒气体,反应 ①是炼铁工业中的主要反应,它们之间的相互转化关系如图所示:
(1)反应①的化学方程式是 。
(2)反应②的化学方程式是 。
(3)F物质的化学式是 。
(4)在②中若加入的硫酸过量,则在反应③中还会产生一种非金属单质是 。
如图所示是两种元素在元素周期表中的信息.

(1)、氧元素的原子序数是 .
(2)、氢元素属于 (填“金属”或“非金属”)元素.
(3)、氢元素和氧元素组成的两种化合物分别是 和 .(写化学式)
实验室有一瓶标签模糊的烧碱溶液,小杰设计实验测定了其溶质质量分数.请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)
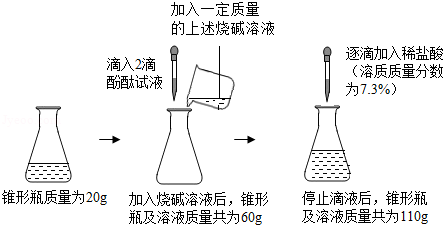
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好 时,停止滴液,反应所消耗稀盐酸的质量为 g.
(2)通过计算确定该瓶烧碱溶液的溶质质量分数.(写出计算步骤)
(3)问题讨论:小红做同样的实验得到的结果比小杰得到的结果偏小,从实验操作的角度分析产生这种误差的原因可能是 (填写一条即可)
有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
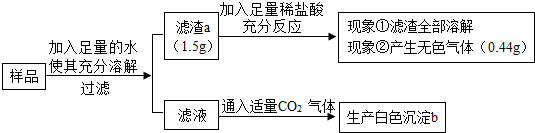
请回答下列问题:
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(2)滤渣a的成分是 ,滤液中溶质的成分除氯化钠还有 ,白色沉淀b的成份是 。
(3)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是 。
某班学生分三组分别做了二氧化碳制取和性质验证实验,如图所示。实验结束后,老师取两份等质量的丙废液,分别与甲、乙废液混合,将甲废液与丙废液倒入烧杯A中,有白色沉淀生成;将乙废液与丙废液倒入烧杯B中,有气泡产生。请填空:
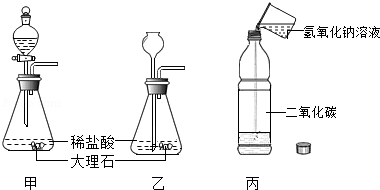
(1)甲废液与乙废液所含溶质的成分可能不同的是 (用化学式填空,下同)
(2)烧杯A中沉淀的成分一定有 。
(3)另取少量丙废液样品,加入足量的氯化钡溶液,有白色沉淀生成,过滤,向滤液中滴加氯化铁溶液,观察到有红褐色沉淀生成,未发现其他明显现象。由此推测出,丙废液溶质的成分是 ,丙废液与氯化钡溶液反应的化学方程式为 ,烧杯A的上层清液中溶质的成分一定有 。