化学是一门以实验为基础的科学,根据如图所示的实验,请回答下列问题:
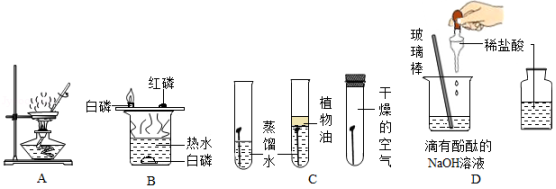
(1)A图所示的实验中,玻璃棒的作用是 。
(2)B图所示的实验中,由铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明燃烧需要 ;烧杯中热水的作用 (答出一点即可)。
(3)通过C图所示的实验,可以得出铁制品锈蚀的条件为:铁与 反应。
(4)D图所示的实验中,加入酚酞的作用是 ;实验中逐滴加入稀盐酸的目的是 。
如图是测定空气里氧气含量的实验装置,请回答有关问题.

(1)A装置中,燃烧停止后,红磷仍有剩余,燃烧停止的原因是 .
(2)B是改进后的装置,小试管和铜片的组合代替了燃烧匙.开始实验时,向小试管中加入90℃以上的热水后,白磷燃烧.从燃烧条件考虑,热水的作用是 ;
装置冷却到室温后,打开弹簧夹,可观察到烧杯中的水进入集气瓶,最终约占瓶内空气总体积的 .
(3)与A相比,B装置的优点是 (答一点即可).
如图为实验室制取气体的常见装置,请回答:

(1)实验室用高锰酸钾制取氧气,反应的化学方程式为 ,为防止固体粉末进入导气管,应采取的措施是 .
(2)实验室采用B装置制取氢气,在操作上具有的优点是 ,收集装置应选用的装置为 (选填字母序号).
(3)若用F装置干燥氧气或氢气,气体应从 (选填"a"或"b")端通入.
如图是初中化学中的四个小实验,请回答:

(1)A中 能燃烧磷的着火点为40℃,红磷的着火点为240℃.
(2)B中水的作用是 .
(3)C实验在操作无误的情况下可得出的结论是 .
(4)D实验可得出CO 2具有的化学性质是 .
为了证明氢氧化钙溶液与稀盐酸能发生反应,氢氧化钠溶液与二氧化碳能发生反应。如图所示进行实验(装置气密性良好,实验前弹簧夹K1、K2处于关闭状态)
资料:CaCl2+Na2CO3═CaCO3↓+2NaCl
实验一:氢氧化钙溶液与稀盐酸恰好完全反应。
(1)实验过程中需缓缓通入氮气,其作用是什么?
(2)写出氢氧化钙溶液与稀盐酸恰好完全反应的实验操作及现象。
实验二氢氧化钠溶液与二氧化碳反应。
(3)打开活塞Ⅱ,将足量氢氧化钠溶液加入锥形瓶中,立即关闭活塞Ⅱ,写出利用图示装置证明氢氧化钠溶液与二氧化碳反应的实验操作及现象。
(4)实验后,取B中锥形瓶内的溶液,倒入烧杯中,若溶液呈红色,设计实验方案,探究该溶液中是否有氢氧化钠,写出实验操作、预期现象和结论。

为了验证锌、铁、铜、银的金属活动性顺序,某同学进行如图所示的实验.

(1)该同学能否达到实验目的?说明理由.
(2)自选四种试剂,另外设计实验方案,证明以上四种金属的活动性顺序,写出实验操作、现象和结论.