水是生命之源,也是人类宝贵的资源。请回答下列问题:
(1)下列“水”属于纯净物的是 (填序号)。
A.蒸馏水B.清澈的河水C.自来水D.湛蓝的海水
(2)生活中为降低水的硬度并杀灭水中的病原生物,可采用的方法是 。
(3)实验室中常通过 的操作来除去水中不溶性的杂质,该操作需要用到的玻璃仪器有烧杯、 、玻璃棒,其中玻璃棒的作用是 。
(4)某同学在完成电解水实验时,发现正极产生了8mL气体,则负极产生的气体体积约为 mL,该实验能够说明水是由氢元素与氧元素组成的理论依据是 。
(5)爱护水资源从我做起,下列做法不可行的有 (填序号)。
A.洗脸、刷牙、洗澡时随时关闭水龙头
B.用洗菜、洗衣的水冲厕所、拖地板
C.将生活废水排入河流
D.合理使用化肥和农药
由我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原于质量新值,其中他测定核电荷数为63的铕元素的相对原子质量新值为152,则该元素的原子中质子数=,中子数=,核外电子数=。
某元素A的原子结构示意图为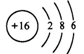
该元素原子的核电荷数为,
原子的最外层电子数是,A属元素。(填金属、非金属或稀有气体),A原子通过得失电子而形成的离子的符号是 。
在五氧化二磷、氯酸钾、二氧化锰、水、二氧化碳、空气、氧气、碳中,①属于混合物的是_______,②属于纯净物的是_______,③属于单质的是_______,④属于化合物的是_______,⑤属于氧化物的是_______,⑥含有氧分子的是_______。
元素周期表是学习和研究化学的重要工具。下图是元素周期表的一部分。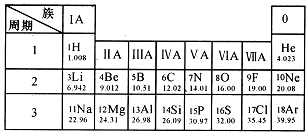
①查出碳的相对原子质量为,原子序数为17的元素符号为。
②表中不同种元素最本质的区别是
用肇庆特产之一桂皮蒸镏可以得到桂油,其主要成分是肉桂醛(C9H8O),它可作为饮料和食品的增香剂。则肉桂醛中含有种元素,1个肉桂醛分子中有个原子。