某化学兴趣小组同学学习海水"制碱"知识后,到实验室做实验,小华实验:先取2mL Na 2CO 3溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;小红实验:先取2mL稀盐酸于试管中,再用胶头滴管滴入少量Na 2CO 3溶液,却马上观察到有气泡产生,两人实验所用的Na 2CO 3溶液、稀盐酸均相同,却观察到不同的实验现象,他们为了查明原因,查阅资料:
①HCl和Na 2CO 3反应时其实是分步进行的,即:
Na 2CO 3+HCl═NaCl+NaHCO 3(先),NaHCO 3+HCl═NaCl+H 2O+CO 2↑(后)。
②NaHCO 3溶液与足量澄清石灰水混合会变浑浊。
③Ca(HCO 3) 2溶于水
请回答:(1)NaHCO 3俗称 ;
(2)NaHCO 3在医疗上是治疗 的药剂之一。
【提出问题】小华实验后溶液中的溶质是什么?
【猜想与假设】猜想①NaCl;②NaCl、NaHCO 3;③NaCl、Na 2CO 3;④NaCl、Na 2CO 3、NaHCO 3
【提出质疑】小红认为猜想 一定不正确。
【实验探究】
实验操作 |
实验现象 |
结论 |
取适量小华实验后的溶液于试管中,滴入澄清石灰水 |
溶液变浑浊 |
猜想④成立 |
【交流与反思】(1)大家一致认为上面实验探究结论不正确,原因是 (用化学方程式表示)。
(2)小红认为,小华实验后的溶液应该继续慢慢滴入稀盐酸,若一开始无明显现象,一会后观察到有气泡产生,则猜想 成立。
【归纳与总结】小华实验与小红实验现象不同的主要原因与 有关。
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反虚后的产物。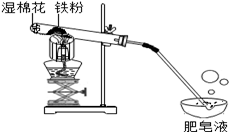
(1)试管尾部放一团湿棉花的目的是_____________
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。
说明生成的气体是______________
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
还查阅到 Fe3O4能和稀盐酸发生反应,生成金属化合物和水
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________
【实验探究】
| 实验操作 |
实验现象及结论 |
| 若固体全部溶解,没有气泡冒出,剩余固体是Fe3O4.若固体全部溶解,有气泡冒出,剩余固体是Fe与Fe3O4. |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________
小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空每空1分,计算3分,计9分)
【猜想与假设】
猜想1.可能是淀粉(不溶) 猜想2.可能是纯碱
猜想3.可能是食盐猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应,淀粉不溶解于水中
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| (1)取样,溶于适量的水 |
形成无色溶液 |
猜想不成立 |
| (2)取少量品尝 |
有涩味 |
不是 |
| (3)向(1)的溶液中滴加酚酞试液 |
溶液变红 |
是纯碱 |
小华认为,实验(3)结论不准确,原因是。小华进一步进行了如下实验,取28g所配溶液与50.2g氯化钡溶液混合,两物质签好完全反应。立即出现,由此他知道了该白色粉末是何物。过滤,所得滤液的质量为58.5g,试计算
(4)反应后生成的沉淀质量为克。
(5)所得滤液中溶质的质量分数为多少?
(13分)氧气和二氧化碳是初中化学常见的两种重要物质。请你参与下列氧气和二氧化碳有关制备、转化的实验探究活动。
Ⅰ:实验室制取氧气和二氧化碳。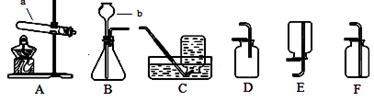
(1)图中仪器的名称:a,b。
(2)用装置A制取氧气,发生反应的化学方程式。要制得较纯净的氧气,应该选择装置收集。
(3)制取并收集一瓶二氧化碳,可选择装置;向装置中加入药品前的一步实验操作是。该组合装置既可用于制取二氧化碳又可用来制取氧气,其中选用相同发生装置制取二氧化碳和氧气的原因是。
Ⅱ:用过氧化钠反应来制取氧气,是潜水员使用的供氧装置的原理。
【查阅资料】常温常压下过氧化钠是淡黄色固体,在不需要加热的情况下能与二氧化碳反应生成氧气和另一化合物(生活中常见的盐);过氧化钠能与水反应生成氧气和氢氧化钠。
【设计装置】为验证过氧化钠(Na2O2)和CO2反应生成的气体,设计如下实验装置。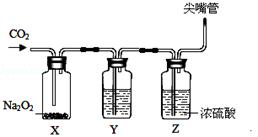
【实验操作】向装置X中通入足量CO2气体,观察到X瓶中的淡黄色固体逐渐变为白色粉末,同时见到Y、Z装置中有气泡出现。
【实验分析】
(4)Y中的溶液是;Z中浓硫酸的作用是。
(5)验证过氧化钠和二氧化碳反应生成氧气的操作是。
(6)反应结束后,可设计一个简单实验,验证X瓶中过氧化钠是否有剩余(除用二氧化碳验证外),其实验原理是(用化学方程式表示)。
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题。小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳(二氧化碳能溶于水)和氮气。探究分两步进行。
(1)测量鳔内气体体积。小明设计了两种方法:
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图)。
你认为两种方法中合理的是;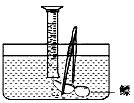
(2)探究鳔内气体的成分。给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设。
| 验证 |
方法 |
现象 |
| 鳔内含O2 |
||
| 鳔内含CO2 |
在学习过程中,小明同学提出一个问题:“碳燃烧时可能生成CO2,也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?”
[猜想]碳与氧化铜反应生成的气体中:①只有CO2;②既有CO,又有CO2;③只有CO。
[查阅资料]浸有磷钼酸溶液的氯化钯试纸遇CO2无变化,但遇到微量CO会立即变成蓝色。
[方案设计]通过上述资料和已有知识,小明初步设想用浸有磷钼酸溶液的氯化钯试纸和澄清石灰水对碳与氧化铜反应生成的气体进行检验。根据小明的设想,请你填空:
(1)若试纸不变色,澄清石灰水变浑浊,则只有CO2;
(2)若试纸变成蓝色,澄清石灰水变浑浊,则既有CO,又有CO2;
(3)若试纸_____________,澄清石灰水_____________,则只有CO。
[实验验证]经过思考之后,小明设计了下图实验装置:
实验步骤:(1)打开弹簧夹,先通一会儿纯净、干燥的N2;
(2)关闭弹簧夹,点燃酒精灯加热。
[结论]小明通过分析实验现象,确认猜想②是正确的,请你写出装置C中发生反应的化学方程式:___________________________________________;
[反思与评价](1)该实验开始前通一会儿N2的目的是:_______________________;
(2)请从环保的角度分析该实验装置中的不完善之处_____________________________。