梧州市某化学兴趣小组检测某硫酸厂排放的废液中硫酸的含量,取废液样品100g,逐滴加入4%的NaOH溶液,溶液的pH随加入NaOH溶液质量变化如图所示(假设废液中其它成分均为中性,且不和NaOH反应)。
请计算:
(1)H 2O的相对分子质量= 。
(2)该废液中硫酸的质量分数。(结果精确到0.01%)

化学泡沫灭火器是常用灭火器之一,其反应原理为: 。现将34.2kg质量分数为10%的 溶液与270kg 溶液混合,恰好完全反应(假设生成的气体全部逸出)。
已知相对分子质量: 342; 142; 78。
试计算:
(1) 中O元素与S元素的质量比为 。
(2)最后所得溶液中 的质量分数。
(3)将34.2kg 溶液的溶质质量分数由10%变为20%可以用不同方法。请选择一种方法进行计算(只写出计算过程,不答具体操作)。
我国核工业技术世界领先,现已出口到西方发达国家。极硬的陶瓷材料碳化硼( )可用作核反应堆的中子吸收剂,还可用于制造坦克装甲、防弹背心等。在电弧炉中用C与 反应制得 ,反应的化学方程式为 。按此反应,当消耗70千克 时,可制得 多少千克?
含碳燃料燃烧会排放二氧化碳,使用氢能等新能源能降低碳排放。12g碳完全燃烧,生成二氧化碳的质量是多少?
某化肥厂生产的一种化肥包装袋上的部分说明如图所示。化学兴趣小组为测定其纯度,做了以下实验(杂质溶于水,且不与硝酸银溶液反应),请根据如图所示的实验过程和提供的数据进行计算。
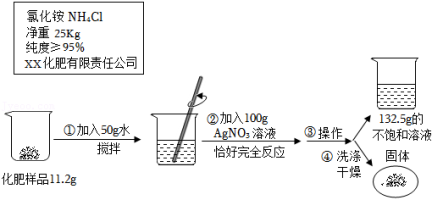
(1)过滤后最终所得固体的质量为 g;
(2)所用硝酸银溶液的溶质质量分数是多少?(写出计算过程)
(3)该化肥是否合格?(写出计算过程,计算结果精确到0.1%)
实验室用质量分数为20.0%的稀硫酸处理含 的废液。向100.0g废液中加入稀硫酸至溶液恰好呈中性,最终得到2.33g沉淀。请计算:
(1)配制490.0g20.0%的稀硫酸需质量分数为98.0%的浓硫酸 g。
(2)废液中 的质量分数。