根据下列实验示意图回答问题:

(1)A图所示实验为测定空气中氧气含量,该实验可得出关于氧气含量的结论是 。
(2)B图所示实验为探究燃烧条件,根据该现象能得出燃烧的条件是 。
(3)C图所示实验为蒸发操作,玻璃棒的作用是 。
(4)D图所示实验反应后天平不平衡,其原因是 。该反应是否遵守质量守恒定律? (填“是”或“否”)。
有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
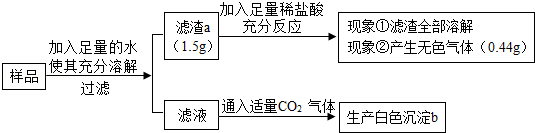
请回答下列问题:
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(2)滤渣a的成分是 ,滤液中溶质的成分除氯化钠还有 ,白色沉淀b的成份是 。
(3)若现象①"滤渣全部溶解"变为"滤渣部分溶解",其他现象不变,则原样品中不能确定是否存在的物质是 。
某班学生分三组分别做了二氧化碳制取和性质验证实验,如图所示。实验结束后,老师取两份等质量的丙废液,分别与甲、乙废液混合,将甲废液与丙废液倒入烧杯A中,有白色沉淀生成;将乙废液与丙废液倒入烧杯B中,有气泡产生。请填空:

(1)甲废液与乙废液所含溶质的成分可能不同的是 (用化学式填空,下同)
(2)烧杯A中沉淀的成分一定有 。
(3)另取少量丙废液样品,加入足量的氯化钡溶液,有白色沉淀生成,过滤,向滤液中滴加氯化铁溶液,观察到有红褐色沉淀生成,未发现其他明显现象。由此推测出,丙废液溶质的成分是 ,丙废液与氯化钡溶液反应的化学方程式为 ,烧杯A的上层清液中溶质的成分一定有 。
实验是进行科学探究的重要方式,某同学设计如图所示实验,探究二氧化碳的有关性质。请填空:

(1)实验1采用科学探究中的控制变量法,该实验控制的变量是 。
(2)实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是 ,该反应的化学方程式是 。
(3)实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第 (填序号)号棉球先变色,通过此现象可获得关于二氧化碳的另外一条性质是 。
t 1℃时,将a、b两种固体各18g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图甲所示,升温到t 2℃时,现象如图乙所示,a、b两种固体在水中的溶解度曲线如图丙所示。

请填空:
(1)从t 1℃到t 2℃的变化过程中,一直处于饱和状态的是 (填"a"或"b")的溶液。
(2)图丙中曲线M表示的是 (填"a"或"b")的溶解度曲线。
(3)若a中混有少量的b,可采用 结晶的方法提纯a。
酸奶是日常生活中常见的一种食品,如表是某酸奶外包装上标识的营养成分表.
|
项目 |
能量 |
蛋白质 |
脂肪 |
糖类 |
钠 |
|
每100g |
329kJ |
2.6g |
3.1g |
10.0g |
60mg |
请填写下列空格:
(1)酸奶中的 在消化道内会逐渐被分解成可被人体吸收的多种氨基酸.
(2)脂肪在人体内分解、氧化释放出能量的过程,是将 能转化为热能.
(3)蔗糖(C 12H 22O 11)是酸奶中的一种糖类物质,蔗糖的组成中碳、氢元素的质量比为(最简整数比) .
(4)在选择制作酸奶包装盒的材料时,从化学性质的角度分析该材料应具备 的特点(填写一条即可)