实验室制取氧气,提供了下列药品和常用装置,请按要求回答有关问题:
药品:①过氧化氢溶液 ②氯酸钾 ③二氧化锰
装置:

(1)装置中仪器a的名称为 。
(2)若小明选择装置A和C来制取氧气,则他选择的药品应为 (填序号);若用装置D收集氧气,则验满的操作方法为将带火星的木条伸到 ,观察木条是否复燃。
(3)某气体X可用D装置收集,若改用E装置收集,则气体X应从 口进(填“b”或“c”)。
学习化学知识后,观察物质世界就要从化学视角看。水是一种重要的物质,请按要求回答下列问题:
(1)从组成角度看:水是由组成的,世界上形形色色的物质都是由一百余种元素经过不同组合而形成的。
(2)从微粒角度看:水是由构成的,构成物质的基本微粒有。
(3)从变化角度看:化学变化不但生成新物质而且还伴随能量变化。
①水通电分解生成未来最理想的能源——氢气,是将能转化为能,但该方法不节能,需要寻找更为有效的节能方法,以促进水的分解;②水参加植物光合作用的化学方程式为:6CO2+6H2O 6O2+X,则X的化学式:。
6O2+X,则X的化学式:。
(4)从资源角度看:水是生命之源。饮用酸碱度过大或硬度过大的水都不利于人体健康。可用测定水的酸碱度。检验水是硬水还是软水,可用的物质是。请你说出生活中使硬水软化的一种常用方法。看到上侧漫画,你的感想是:。(解读漫画或写一则节水广告或一条节水措施)。
“从生活走进化学,从化学走向社会”。请你用化学知识回答以下问题:
燃料和食品在人类社会的发展中起着相当重要的作用。
(1)下面是人类大规模使用燃料的大致顺序:木柴→木炭→煤→石油、天然气。
①上述燃料中属于化石燃料的是;这些化石燃料属于能源(填“可再生”或“不可再生”);上述燃料中通常被称为“清洁能源”的是。
②天然气的主要成分是(填化学式),其完全燃烧的化学方程式为:。
(2)现代社会对能量的需求量越来越大,化学反应提供的能量已不能满足人类的需求。人们正在利用和开发新能源,如。(举一例)
(3)节假日或双休日,去郊游野炊实为一大快事。
①对野炊有经验的的人会告诉你,餐具最好是导热性好,不易破碎的材料制的,你准备带的餐具是用:制的;(填字母)
A.金属B.陶瓷 C.塑料
②在“灶”上悬挂野炊锅时,应调节野炊锅到合适的高度。你觉得原因可能是:
;
③野餐食谱如下:主食:馒头配菜:烤火腿、鲫鱼汤、五香豆干。
主食和配菜中主要含蛋白质、、油脂、无机盐和水等营养素,从营养角度来看,你准备再添—样;(填字母)
A.炒鸡蛋 B.牛奶 C.黄瓜 D.烤野兔肉
④在引燃细枯枝后,如果迅速往“灶”里塞满枯枝,结果反而燃烧不旺,并产生很多浓烟,说明物质充分燃烧需要的条件是;
地沟油中含有一种强烈致癌物黄曲霉素(C17H14O6),长期食用会引起消化道癌变,请回答:
(1)黄曲霉分子(C17H14O6)中含有个原子;
(2)黄曲霉素(C17H14O6)中碳、氢两种元素的质量比为;
(3)黄曲霉素分子中(C17H14O6)碳原子:氧原子:氢原子个数比为;
(4)黄曲霉素(C17H14O6)的相对分子质量是;
(5)15.7g黄曲霉素中含有g氧元素。
我们已经学习过实验室制取一些气体的反应原理、发生装置及收集方法,请根据图仪器及题目要求回答问题。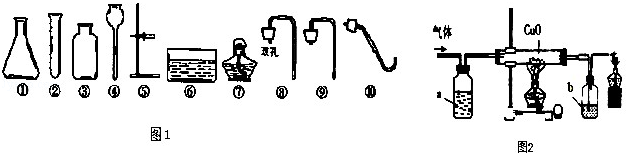
(1)写出图1中仪器的名称:①,⑥。
(2)如果用大理石和稀盐酸制取二氧化碳,发生装置可选用上图仪器中的(填序号),其化学方程式。
(3)若用加热固体KMnO4来制取并用排水法收集一瓶O2,发生装置和收集装置可选用图1仪器中的(填序号),写出氧气验满的操作方法:。
(4)某同学用含有CO2的CO来还原CuO、并检验产物是CO2,他设计了如图2所示的实验装置.请将他设计的装置图补画完整(画在图2中),图中试剂a最好是(选 填“NaOH溶液”或“Ca(OH)2溶液)。装置末端放一燃烧的酒精灯的作用是。
下面三个实验都是教材中的化学实验,请回忆并解决有关问题
(1)实验A证明蜡烛燃烧产生的火焰,外焰温度最(填“高”或“低”)。
(2)实验B是硫在氧气中燃烧实验,瓶中预先加水的目的是:。
(3)实验C是蒸馏水的制取,蒸馏过程中进入冷凝管中水的流向是(“下入上出”或“上入下出”);高温水蒸气的冷却成小水珠,从微观角度看是水分子的减小了。