某化学兴趣小组用一定浓度的稀盐酸和含杂质5%(杂质不与盐酸反应)的石灰石制备CO2,他们选择的制取和收集装置如图所示。请按要求回答问题和探究:
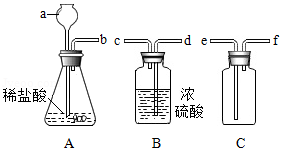
(1)装置A中仪器a的名称是 ,若要制取并收集干燥的CO2,导管的连接顺序是 。
(2)若消耗的石灰石为100g,理论上可得到CO2 g(精确到0.1),但实际收集到的CO2质量与理论值不符,原因可能是 (填一种)。
(3)探究装置A中残留液的溶质成分。
【提出问题】残留液中含有哪些溶质?
【查阅资料】CaCl2溶液呈中性。
【思考判断】残留液中一定含有的溶质是 (填物质名称),可能含有的溶质是HCl。
【实验验证】同学们通过多种实验方法,均验证了残留液中的溶质有HCl,请完成下表。
实验操作 |
现象(数据或化学方程式) |
结论 |
|
方法一 |
用酸碱指示剂测定溶液的酸碱性,所选择的指示剂为 。 |
现象: |
残留液中的溶质有HCl |
方法二 |
用pH试纸测定溶液的pH。 |
pH 7 (填>、=或<) |
|
方法三 |
用化学药品检测,且发生了复分解反应,可能选用的药品为 (填一种物质的化学式)。 |
现象: 化学方程式:
|
已知:2Na 2O 2+2CO 2=2Na 2CO 3+O 2;2Na 2O 2+2H 2O=4NaOH+O 2↑.为了证明过氧化钠(Na 2O 2)固体可在呼吸面具和潜水艇中做供氧剂,某化学兴趣小组的同学利用如图所示实验装置进行探究活动。(铁架台等已略去)

(1)A装置中所发生反应的化学方程式为 。
(2)请将如图F方框中A装置的长颈漏斗和玻璃导管补画完整。
(3)D装置的作用是 。E装置中可能发生的有关反应的化学方程式为 。
(4)为了达到实验的目的, 以上装置导管接口正确的连接顺序为a接 、 接 、 接 、 接b。
(5)氧气可采用B装置收集并用带火星的木条检验,这是利用了氧气的哪些性质?
(6)实验结束后,取C装置中固体溶于水,无气泡产生。请设计实验,检验C装置中固体的成分。(简要写出实验步骤、现象和结论)。
(7)某潜水艇上有100人,如果每人每分钟消耗氧气为0.001kg,假如所需要的氧气全部由Na 2O 2与CO 2反应来提供,则该潜水艇一天所需要Na 2O 2的质量是多少?
为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。

(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是 。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式 。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质?(BaSO4不溶于水,也不溶于酸)
某金属(用R表示)能与盐酸发生置换反应,其金属活动性弱于Zn,相对原子质量小于65.向一定质量的AgNO3、Cu(NO3)2和R(NO3)2混合溶液中加入Zn,充分反应后过滤,得到固体和溶液。向所得到的固体上滴加盐酸时有气泡产生。
(1)写出R与盐酸反应的化学方程式。
(2)所得到的固体中一定含有哪些金属?
(3)所得到的溶液的质量与原混合溶液的质量相比,可能增大,其原因是什么?
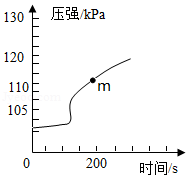
某化学兴趣小组的同学利用压强传感器、数据采集器和计算机等数字化实验设备,测定铝片与足量稀硫酸反应时气体压强的变化,实验结果如图所示。
(1)开始一段时间气体压强几乎不变,其原因是什么?
(2)写出m点时所发生反应的化学方程式。
如图是氢氧化钠与盐酸反应示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
