某研究小组对自动充气气球(示意图如图1)进行下列探究。
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)为检验气体是二氧化碳,可选用 (填试剂名称)。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈 性。
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想 (填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验编号 |
锥形瓶内物质 |
最终得到CO2体积/mL |
|
名称 |
质量/g |
||
① |
碳酸氢钠 |
0.10 |
V1 |
② |
碳酸钠 |
0.10 |
V2 |
③ |
白色粉末 |
x |
V1 |
实验①的化学方程式为 ;表中x= ;V1 V2(填“>”、“<”或“=”)、
[分析并得出结论]
(5)白色粉末是 。

KOH溶液中含有H2O、K+、OH、能使无色酚酞试液变成红色。某化学兴趣小组想探究KOH溶液使无色酚酞试液变成红色的原因。
【提出问题】KOH溶液中的什么成分使无色酚酞试液变红?
【猜想】猜想1:KOH溶液中的H2O使无色酚酞试液变红。
猜想2:KOH溶液中的K+使无色酚酞试液变红。
猜想3:KOH溶液中的_______________(填化学式)使无色酚酞试液变红。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| ①用试管取少量蒸馏水,滴入12滴无色酚酞试液 |
A试管内溶液不变色 |
猜想1不成立 |
| ②用试管取少量KCl溶液,滴入12滴无色酚酞试液 |
B |
猜想2不成立 |
| ③________________,滴入12滴无色酚酞试液 |
C试管内溶液变红 |
 |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学理由是__________________。
【拓展】①向Ba(OH)2溶液中滴入几滴无色酚酞试液,观察到的现象是________________;
②KOH固体应__________保存。
小秋同学对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。请填写下列空格
(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛浮在水面上。结论:石蜡的密度比水__________;
(2)点燃蜡烛,观察到火焰分为外焰、内焰、焰心三层。把一根火柴梗放在火焰中(如图)约1s后取出可以看到火柴梗的a处最先碳化。结论:蜡烛火焰的_________温度最高;
(3)再将一支干燥的烧杯罩在蜡烛火焰上方,烧杯内壁出现水雾。取下烧杯,迅速向烧杯内倒入少量澄清的石灰水,振荡。澄清石灰水变浑浊。结论:蜡烛燃烧以后的生成物是_____________和____________
(4)小蓓同学进一步对蜡烛燃烧产生火焰的原因产生了兴趣点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由________(填“固态”或“气态”)物质燃烧形成的。
查阅资料
| 物质 |
熔点╱℃ |
沸点╱℃ |
燃烧时温度╱℃ |
| 石蜡 |
50∽70 |
300∽550 |
约600 |
| 铁 |
1535 |
2750 |
越1800 |
| 钠 |
97.8 |
883 |
越1400 |
由上表可知:物质燃烧能否产生火焰与其 (填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时, (填“有”或“没有”)火焰产生。
用来测定空气成分的方法很多。如下图所示的是小芳同学用红磷在空气中燃烧的测定方法。实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸 入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
(1)上面的实验同时证明了氮气有___________的化学性质。 (答一点即可)
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是________________________:_________________________。 (答两点即可)
【问题提出】有实验资料表明:此实验因为设计缺陷,在操作规范的情况下也常常测出氧气的含量会大于1/5
(3)小包同学设想用其他物质代替红磷进行实验(装置不变),则下列因素不会影响实验结果的是(填字母标号):_________
| A.替代物能否和氧气反应 | B.替代物的用量 |
| C.替代物能否溶于水 | D.生成物的状态 |
【实验改进】
Ⅰ. 根据铁在空气中生锈的原理设计图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
Ⅱ.测定实验数据如表4
| 测量 项目 |
实验前 |
实验后 |
|
| 烧杯中水的体积 |
烧杯中剩余水的体积 |
集气瓶(扣除内容物)和导管的容积 |
|
| 体积/mL |
80.0 |
54.5 |
126.0 |
【交流表达】
(4)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化铁[Fe(OH)2],写出该反应的化学方程式 。
(5)根据表4数据计算,改进实验后测得的空气中氧气的体积分数是 (计算结果精确到0.1%)。
(6)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:_________________________;(写一点)
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题。小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳(二氧化碳能溶于水)和氮气。探究分两步进行。
(1)测量鳔内气体体积。小明设计了两种方法:
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图)。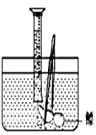
你认为两种方法中合理的是(填编号) ,
为什么 ?
(2)探究鳔内气体的成分。给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设。
| 验证 |
方法 |
现象 |
| 鳔内含O2 |
||
| 鳔内含CO2 |
某化学兴趣小组利用以下装置探究气体的制取及性质。结合下图回答有关问题:
请结合图示实验装置,回答下列问题。
(1)用加热高锰酸钾制氧气选用发生装置是 ;该反应的符号表达式为
若用装置G收集氧气,氧气应从 端通入(选填“a”或“b”),用此装置收集氧气时检验氧气收集满的方法
(2)已知CO2能溶于水且与能水反应,密度比空气大,实验室可用块状大理石和稀盐酸来制取CO2,可选用的装置组合是 ,若用F装置收集CO2,油层的作用是 。
(3)小明同学选用如图所示的装置制取氧气。制取过程中所发生的符号表达式为: 实验前小明同学先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现。该实验操作的目的是 。
(4)小红同学通过互联网得知:CuSO4溶液、动物某些脏器中含有的物质等能催化过氧化氢的分解。
【初次探究】实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解,如果要确定CuSO4是催化剂,还必须通过实验确定它在化学反应前后
【再次探究】CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),稀硫酸中含有三种粒子(H2O、H+、SO42-)为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小红同学作了以下分析和设计。
①小红同学认为最不可能的是H2O,他的理由是 。
②要说明另外的两种粒子是否起到催化作用,小红同学设计了如下实验,完成了这次探究活动。
| 实验步骤 |
实验现象 |
结论 |
| a. 取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 |
溶液几乎没有气泡放出 |
实验证明,起催化作用的是 |
| B. 另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴氯化铜溶液[来 |
溶液中有大量气泡放出 |
(5).小玲同学称取一定质量的高锰酸钾固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,该同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想 I:反应生成的二氧化锰分解放出O2;
猜想Ⅱ:反应生成的锰酸钾分解放出O2;
猜想Ⅲ:
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想______错误;
第二组同学取高锰酸钾在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是__ ____.
【拓展延伸】实验发现,氯酸钾固体加热制取氧气的反应速率很慢,但如果将高锰酸钾固体与氯酸钾固体混合加热,则氯酸钾的分解速率大大加快。请说明高锰酸钾在氯酸钾的分解反应中是否作催化剂,为什么?