用化学用语填空:
(1)2个氮原子 ;
(2)氨分子 ;
(3)氧化亚铁 ;
(4)天然气的主要成分 ;
(5)碳酸氢铵 。
根据要求填空
①引起酸雨的主要物质是(1) 。
②煤气的主要成分是 (2) 和氢气。
③常用于人工降雨的固体是 (3) 。(填名称)
④用活性炭除去冰箱异味应用了它的 (4) 性。
⑤丙烷(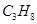 )是液化石油气的主要成分,
)是液化石油气的主要成分,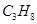 由 (5) 种元素组成,碳元素的质量分数是 (6) (精确到0.1%),0.25mol
由 (5) 种元素组成,碳元素的质量分数是 (6) (精确到0.1%),0.25mol 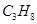 中约含有 (7) 个H原子。
中约含有 (7) 个H原子。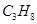 燃烧的化学方程式如下,
燃烧的化学方程式如下,
(8)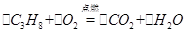 □ 请配平:
□ 请配平:
实验室常用草酸(化学式为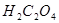 )和浓硫酸混合加热制备一氧化碳,其反应方程式为:
)和浓硫酸混合加热制备一氧化碳,其反应方程式为: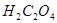
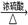
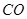 ↑+
↑+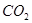 ↑+
↑+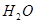 。下图是制备干燥的
。下图是制备干燥的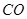 ,再用
,再用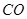 还原氧化铜并检验其反应产物的实验装置。
还原氧化铜并检验其反应产物的实验装置。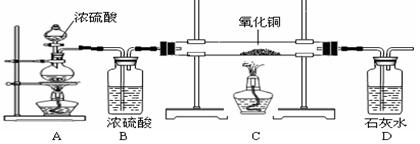
①从安全角度讲,实验开始时应先加热(9)(填A或C)处。
②写出C处反应的化学方程式(10),D处的现象(11)。
③为了能正确检验反应后的产物,某同学认为在装置 (12) 和 (12) 之间还应增加个洗气瓶(下图),该同学在洗气瓶中加入的溶液是(13)。
④从环保的角度讲,该装置存在的缺陷是(14)。
以下是一些制取气体的实验,请你一起参与探究。
①某探究小组在实验室用下图所示装置制取气体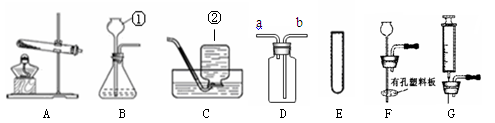
Ⅰ.写出仪器的名称:①(1)②(2)。
Ⅱ.写出实验室用A装置制取氧气的化学方程式(3)。
实验室还可用二氧化锰与双氧水制取氧气。若要较好地控制产生氧气的速度,可以从E~G中选取(4) (选填序号)组装成新的气体发生装置。
Ⅲ.若用D装置进行排空气法收集二氧化碳,气体应从(5)(填“a”或“b”)端通入,检验二氧化碳已集满的方法是(6)。
②为探究催化剂的种类对过氧化氢分解速度的影响,在相同条件下,同学们按下表进行实验并记录相关数据。(其他影响实验的因素均相同)
| 编号 |
过氧化氢溶液质量/g |
催化剂质量/g |
待测数据 |
| 实验1 |
50.0 |
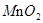 0.2 |
|
| 实验2 |
50.0 |
CuO X |
Ⅰ.表中X的数值应是(7)。
Ⅱ.表中的待测数据指(8)(填字母序号)。
A.氧气的质量 B.单位时间内产生氧气的质量
C.氧气的体积 D.单位时间内产生氧气的体积
甲、乙两种物质的溶解度曲线如图所示。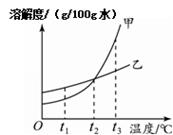
①(15)℃时,甲、乙的溶解度相等。
②若甲中含有少量乙,提纯甲可采用的方法是(16)。
③将t1℃时等质量的甲、乙饱和溶液升温至t2℃,若采用加溶质的方法使两者重新达到饱和,则(17)物质所加的量多。
④t1℃时,向一只盛有15g甲的烧杯中加入50g水,充分搅拌后烧杯底部仍有未溶解的固体。下列相关叙述不正确的是 (18) 。
| A.t1℃时,甲的溶解度为30 g/100g水 |
| B.烧杯中溶液的质量小于65g |
| C.降温后烧杯中溶液总质量不变 |
| D.取烧杯中上层清液加热变为不饱和溶液 |
水是宝贵的自然资源。
①活性炭常用于净水,利用其(8) 作用除去水中的颜色和异味。
②电解水实验如图所示。
Ⅰ.a管下方导线应接电源的(9)极(填“正”或“负”),
反应的化学方程式为(10) 。
Ⅱ.为了加快电解速度,可先向水里加入少量氢氧化钠(已知通电时NaOH不发生变化)。配制100g溶质质量分数为10%的氢氧化钠溶液,需氢氧化钠固体 (11) g,量取水(水的密度为 )时,应选择规格为(12) mL(填“10”、“100”或“250”) 的量筒。电解后溶液的溶质质量分数(13) 10%
)时,应选择规格为(12) mL(填“10”、“100”或“250”) 的量筒。电解后溶液的溶质质量分数(13) 10%
(填“<”、“=”或“>”)。
Ⅲ.水曾被误认为是一种单质。下列实验能证明水是由氢、氧元素组成的是(14)。
| A.水的电解 | B.水的蒸发 |
| C.水的蒸馏 | D.氢气在氧气中燃烧 |