如图是初中化学中常见的仪器装置,请认真观察后回答有关问题:

(1)A装置中仪器X的名称: 。
(2)用B装置来收集氢气时,气体应从 (填“a”或“b”)端进入。
(3)实验室用C装置来收集CO2,其中在水面上覆盖一层植物油的目的是 。
(4)用D装置除去粗盐中的杂质时,玻璃棒的下端要斜靠在 。
在化学课上,老师带来一瓶未知溶液A,已知它是稀盐酸或稀硫酸中的一种,进行如下实验(图1):

观察到烧杯中的现象是(1) 。
【提出问题】A是哪一种酸?
老师要求甲、乙同学从反应后的溶液B分别展开探究。
【猜想假设】甲同学:A是稀盐酸;乙同学:A是稀硫酸。
【实验探究】(如图2)
【评价交流】甲同学的实验(2) (填"能"或"不能")得出正确结论,乙同学的实验(3) (填"能"或"不能")得出正确结论。
实验3发生反应的化学方程式为(4) ,反应后所得溶液中一定含有的离子是(5) 。
【归纳总结】通过乙同学的实验可以得出:选择试剂鉴别溶液中的待测离子时,如果待测溶液中含有干扰离子,则应在鉴别前,先另选试剂将干扰离子变成(6) 除去。经讨论我们能够总结出,除去溶液中干扰离子的一般方法是:选择试剂将干扰离子变成(7) 除去。
下列是关于二氧化碳和氧气实验室制取的实验,请回答下列问题:
(1)a仪器的名称是 ,将二氧化碳制取装置图补充完整。
(2)用高锰酸钾制取氧气时,发生反应的化学方程式为 ;加热时,先用酒精灯在试管下方来回移动,其目的是 ,然后对高锰酸钾所在的部位加热。
(3)如果用排水法收集氧气,会发现集气瓶内液面逐渐下降,因为随着反应的进行,瓶内的气体 ,气压 ,使瓶内压强 瓶外压强,在压强差的作用下瓶内水排出,所以液面下降。氧气可用排水法收集的原因是 。

分类是学习化学常用的方法。
(1)物质的用途主要是由它们的性质决定的,请根据下列碱的用途所体现出物质的相关化学性质将它们分类,并参照实例完成空白处内容(填一条即可)
①用氢氧化铝作胃药
②用石灰浆粉刷墙壁
③用熟石灰和纯碱反应制火碱
④用熟石灰制波尔多液
⑤用碱溶液吸收硫酸厂产生的二氧化碳
⑥工厂化验室用氢氧化钠溶液洗涤石油产品中的残余硫酸
(2)化学反应中有些反应没有明显现象,需要设计实验证明化学反应是否发生,请从反应物或生成物变化的角度,将下列实验中的A与 (填"B"或"C")归为一类,理由是:
|
|
|
|
|
A |
B |
C |
根据下列装置回答。
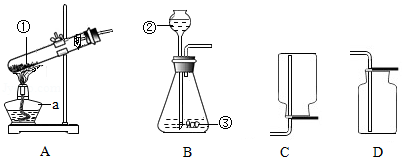
(1)仪器a的名称是 。选用装置A制取氧气,若药品①是高锰酸钾,则装置A中的一处明显错误是 。
(2)选用装置B制取CO 2时,若药品③是块状石灰石,则药品②是 (填"稀硫酸"或"稀盐酸")。用装置 (填字母序号)集满一瓶CO 2,向其中滴入适量澄清石灰水,振荡,可观察到澄清石灰水 (填实验现象)。
(3)实验室里用锌粒与稀硫酸反应制取氢气,发生装置可选用 (填字母序号)。
兴趣小组某同学在做铜与硝酸银溶液反应的实验,当观察到铜丝表面有银白色固体出现时,发现试管内溶液未显蓝色,与所学知识不符。组内同学随即展开讨论,认为溶液未显蓝色是因为铜离子浓度太小,于是对铜离子浓度太小的原因进行了如下猜想:
猜想一:硝酸银溶液浓度不够大。
猜想二:铜丝中含有比铜活泼的金属。
猜想三:
【实验验证】
(1)验证猜想一:你的方案是 。
(2)验证猜想二:取上述相同的铜丝,选择一种酸或盐溶液在相同条件下进行实验,观察实验现象,得出结论。请你在矩形框内画出实验装置图,并标出所选物质。
(3)验证猜想三:进一步实验……
