掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) ,属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO 3在MnO 2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO 2难溶于水)
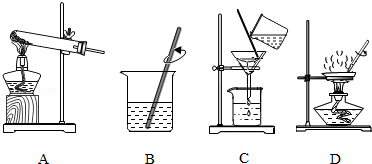
①图A中试管口略向下倾斜的原因是 ,图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 ,图D操作中,当看到 ,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O 2完全反应后,生成64g SO 2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO 2和H 2O,实验测得反应前后物质的质量如下表:
R |
O 2 |
CO 2 |
H 2O |
|
反应前质量/g |
46 |
128 |
0 |
0 |
反应后质量/g |
0 |
32 |
x |
54 |
则x= ,已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .
能源、材料、环保、食品等问题越来越引起人们的重视.请从化学的视角分析下列有关问题并填写空格:
(1)化石燃料包括煤、石油和 .
(2)铝合金可用于制造飞机的外壳,铝合金属于 (选填“合成材料”、“金属材料”或“复合材料”).
(3)塑料在为我们的生活创造便利的同时,也对环境造成不利影响. 人们把塑料给环境带来的危害称为“ ”.
(4)为了合理膳食,营养均衡,生活中把榨好的蔬菜汁放到面粉中,做成口味独特、营养丰富的蔬菜馒头,这种馒头提供的主要营养物质是 和 .
22]属于 (选填“氮肥”、“钾肥”或“磷肥”).
为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实验,请根据图示回答问题:

(1)甲同学设计的实验如图 A 所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针 (选填“向左”、“向右”或“不”)偏转,原因是 。
33),通过实验得出结论:化学反应前后物质的总质量 。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在 装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是 (选填序号)。
①原子种类 ②分子种类 ③原子数目 ④分子质量 ⑤分子数目 ⑥原子质量。
根据下列装置图填空:
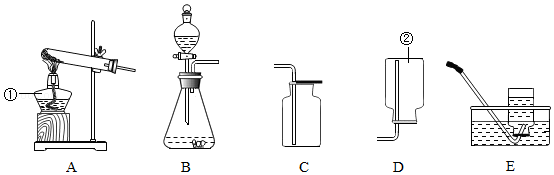
(1)写出图中标有序号的仪器名称:① ;② 。
(2)实验室制取气体时,组装好仪器后,应先 ,再添加药品。
(3)实验室用石灰石和稀盐酸制取二氧化碳时,应选用的发生装置是 (选填装置序号),该反应的化学方程式为 。
(4)实验室选择气体发生装置时,应考虑的因素是 和 。
请用氧气、氯化钠、甲烷、氧化钙四种物质的化学式填空:
(1)供给生物呼吸的是 . (2)用作燃料的是 .
(3)用作干燥剂的是 . (4)用于配制生理盐水的是 .
某化学兴趣小组在实验室用硫酸铜溶液和氯化钡溶液反应制取少量氯化铜溶液,他们的实验过程和相关数据如下(BaSO4不溶于水)
第一步:称得烧杯的质量是100g。
第二步:反应前称得烧杯,氯化钡溶液及硫酸铜溶液的总质量是346.6g。
第三步:两者恰好完全反应后,过滤,称得烧杯及滤液的总质量是300g
请计算:(1)反应后生成沉淀的质量是 。
(2)所得氯化铜溶液中溶质的质量分数(写出计算过程,精确到0.1%)