煤的综合利用有利于保护自然环境和社会的可持续发展。

(1)由煤的结构片段可知:煤的组成元素中除C、H、O、S外还含有 (填元素符号)。
(2)煤的焦化属于 变化;焦化获得的焦炭可用于高炉炼铁,高炉内CO和Fe2O3反应的化学方程式为 ;焦化获得的氨气可用于制取氮肥,区分(NH4)2SO4和K2SO4两种化肥可选用的试剂是 (填对应选项的字母)。
A.氯化钡 B.盐酸 C.熟石灰
(3)煤的气化过程中主要反应是碳与水蒸气生成两种气体燃料,其中一种是单质,该单质是 。
(4)提高煤的燃烧效率能节约煤炭资源,写出一种提高煤的燃烧效率的方法: 。煤中加入适量石灰石燃烧,可发生反应:2CaCO3+O2+2SO2 2CaSO4+2CO2,煤中加入石灰石对环境的意义是 。
2CaSO4+2CO2,煤中加入石灰石对环境的意义是 。
(1)用化学符号或名称填空
①
②
③硫酸根
④氧化钙
⑤2个氮气分子
(2)请用元素符号完成金属活动性顺序表
同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是;
(2)操作①②③都要用到的一种玻璃仪器是,在操作③中,使用这种玻璃仪器的目的是.
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是(只写一种原因).
(4)用提纯所得的氯化钠溶液配制100g6%的氯化钠溶液,若实际所配溶液溶质质量分数大于6%,可能的原因是(填字母编号).
a、称量氯化钠所用天平砝码沾有杂质;b、用量筒取水时俯视读数;c、用量筒取水时仰视读数;d、配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04g/cm3),配制16g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液ml(结果保留小数点后一位).
如图是
的溶解度曲线,A,B,C代表
三种不同状态下的溶液,请回答: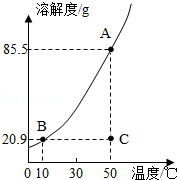
(1)A,B,C中,属于不饱和溶液的是,溶质质量分数最大的溶液是.
(2)将C点溶液转化为B点溶液时,溶液温度应该降至℃.
(3)保持溶剂质量不变,将18.55gA点溶液降温至10℃,可析出
g.
(4)
在不同温度时的溶解度如下:
| 温度/℃ |
0 |
30 |
60 |
90 |
| 溶解度/g |
35.7 |
36.3 |
37.3 |
39.0 |
25℃时,将含
,
各40g的固体混合物投入盛有100g水的烧杯中,充分搅拌,再加热至50℃(溶剂质量保持不变),最终烧杯中剩余的固体成分是.
能源与环境已成为人们日益关注的问题.
(1)人类目前主要依赖的能源是化石燃料,包括煤、石油、;
(2)煤燃烧排放出的、,是形成酸雨的主要根源.
(3)PM 2.5是指大气中直径小于或等于2.5μm的颗粒物,与较粗的可吸入颗粒物相比,PM2.5对人体健康和大气环境质量的影响更大,以下途径中,产生PM2.5的相对较多的是(填字母编号).
a、汽车尾气;b、道路尘土;c、煤炭不完全燃烧排放出炭粒;
(4)为减少污染,提高煤的利用率,目前已采取将煤气化的措施,此过程可看做是碳和水反应生成分子个数比为1:1的可燃性气体.请将其化学方程式补充完整:
+.
请用化学符号回答:
(1)保持氧气化学性质的粒子是;
(2)水在通电分解的过程中,不变的粒子是;
(3)生理盐水在医疗上常用于补充体液和洗涤伤口,该溶液中的溶质是,溶剂是;
(4)碱中都含有的阴离子是.